题目内容
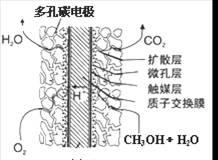
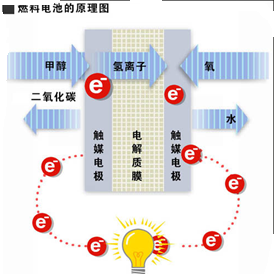 直接甲醇燃料电池(DMFC),它属于质子交换膜燃料电池(PEMFC)中之一类,系直接使用水溶液以及蒸汽甲醇为燃料供给能源,而不需通过重组器高温重组甲醇、汽油及天然气等再取出氢以供发电.下列对于该电池的说法不正确的是( )
直接甲醇燃料电池(DMFC),它属于质子交换膜燃料电池(PEMFC)中之一类,系直接使用水溶液以及蒸汽甲醇为燃料供给能源,而不需通过重组器高温重组甲醇、汽油及天然气等再取出氢以供发电.下列对于该电池的说法不正确的是( )| A、直接甲醇燃料电池低温生电、燃料成分危险性低与电池结构简单等特性 | B、电池工作时,电解质溶液pH值保持不变 | C、电池的负极反应式为3O2+12e-+12H+?6H2O | D、电池工作时,1molCH3OH被氧化时就有6NA个氢离子在正极消耗 |
分析:A.直接甲醇燃料电池低温生电、燃料成分危险性低、电池结构简单;
B.电池工作的原理是氢气与氧气反应生成水的过程,水增多,使硫酸溶液pH增大;
C.原电池负极失电子;
D.根据在闭合回路中正极和负极流过的电子数相等解题.
B.电池工作的原理是氢气与氧气反应生成水的过程,水增多,使硫酸溶液pH增大;
C.原电池负极失电子;
D.根据在闭合回路中正极和负极流过的电子数相等解题.
解答:解:A.直接甲醇燃料电池低温生电、燃料成分危险性低、电池结构简单等,故A正确;
B.该装置中由于水的生成而使硫酸溶液的浓度变小,因此pH值增大,故B错误;
C.原电池负极失电子,应为甲醇失电子,负极反应式为:2CH3OH+2H2O-12e-═12H++2CO2,故C错误;
D.正极发生的电极反应式是:3O2+12H++12e-═6H2O,负极发生的电极反应式是:2CH3OH+2H2O-12e-═12H++2CO2,当1molCH3OH被氧化时,负极失去6mol电子,在正极正极得到6mol电子,消耗的氢离子是6mol,即1molCH3OH被氧化时就有6NA个氢离子在正极消耗,故D正确;
故选:BC.
B.该装置中由于水的生成而使硫酸溶液的浓度变小,因此pH值增大,故B错误;
C.原电池负极失电子,应为甲醇失电子,负极反应式为:2CH3OH+2H2O-12e-═12H++2CO2,故C错误;
D.正极发生的电极反应式是:3O2+12H++12e-═6H2O,负极发生的电极反应式是:2CH3OH+2H2O-12e-═12H++2CO2,当1molCH3OH被氧化时,负极失去6mol电子,在正极正极得到6mol电子,消耗的氢离子是6mol,即1molCH3OH被氧化时就有6NA个氢离子在正极消耗,故D正确;
故选:BC.
点评:本题考查学生燃料电池的工作原理知识,题干信息和图示转化关系是分析的关键,可以根据所学知识进行回答,难度适中.

练习册系列答案
相关题目



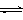 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示:
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示: