题目内容
【题目】某废渣中含有Al 2O3和Cr2O3(三氧化二铬),再次回收利用工艺流程如下。

回答下列问题:
(1)滤液1中阴离子为CrO42-和AlO2-,X的电子式是_______。写出滤液1与过量气体X反应生成Al(OH) 3的离子方程式:_____________________。
(2)“熔烧”中反应之一是4Na2CO3+ 2Cr2O3+ 3O2 =4Na2CrO4+ 4X,该反应中被氧化的物质是______(填化学式);若该反应转移6mol电子,则生成_____mol Na2CrO4。
(3)“还原””中加入适量稀硫酸,调节pH=5,氧化产物为SO42-。写出离子方程式____________。
(4)已知该废料中含铬元素质量分数为a%,wt这样废料经上述流程提取mkgCr2O3。则该废料中铬元素回收率为_______(用代数式表示)。(已知回收率等于实际回收质量与理论质量之比)
【答案】![]() AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Cr2O3 2 8CrO42-+3S2O32-+34H+=6SO42-+8Cr3++17H2O
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Cr2O3 2 8CrO42-+3S2O32-+34H+=6SO42-+8Cr3++17H2O ![]()
【解析】
Al2O3与Na2CO3反应生成NaAlO2和X气体CO2,Cr2O3与Na2CO3反应生成Na2CrO4和X气体CO2,发生的反应为:4Na2CO3+2Cr2O3+3O2 =4Na2CrO4+4CO2,过滤得滤液1中阴离子为CrO42-和AlO2-,通入CO2,得到Al(OH)3,离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。滤液2中CrO42-,“还原””中加入适量稀硫酸,调节pH=5,发生反应:8CrO42-+3S2O32-+34H+=6SO42-+8Cr3++17H2O,加氨水反应后得到Cr(OH)3,加热分解得Cr2O3。
(1)滤液1中阴离子为CrO42-和AlO2-,X是CO2电子式是![]() 。滤液1主要成分为NaAlO2,与过量气体X反应生成Al(OH)3的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。(2)“熔烧”中反应之一是4Na2CO3+2Cr2O3+3O2 =4Na2CrO4+4X,铬元素由+3价升高为+6价,该反应中被氧化的物质是Cr2O3;由方程式每生成4molNa2CrO4,转移12mol电子,若该反应转移6mol电子,则生成2molNa2CrO4。(3)“还原””中加入适量稀硫酸,调节pH=5,氧化产物为SO42-。离子方程式8CrO42-+3S2O32-+34H+=6SO42-+8Cr3++17H2O。(4)mkgCr2O3中含铬mkg×
。滤液1主要成分为NaAlO2,与过量气体X反应生成Al(OH)3的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。(2)“熔烧”中反应之一是4Na2CO3+2Cr2O3+3O2 =4Na2CrO4+4X,铬元素由+3价升高为+6价,该反应中被氧化的物质是Cr2O3;由方程式每生成4molNa2CrO4,转移12mol电子,若该反应转移6mol电子,则生成2molNa2CrO4。(3)“还原””中加入适量稀硫酸,调节pH=5,氧化产物为SO42-。离子方程式8CrO42-+3S2O32-+34H+=6SO42-+8Cr3++17H2O。(4)mkgCr2O3中含铬mkg×![]() ,该废料中含铬元素质量分数为a%,wt这样废料中含铬1000wkg×a%,则该废料中铬元素回收率为
,该废料中含铬元素质量分数为a%,wt这样废料中含铬1000wkg×a%,则该废料中铬元素回收率为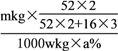 ×100%=
×100%=![]() 。
。

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】下列实验操作、现象与结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向FeCl3和KSCN混合溶液中,加入少量KCl固体 | 溶液颜色变浅 | FeCl3+3KSCN +3KCl平衡向逆反应方向移动 |
B | 向酸性高锰酸钾溶液中加入过量的FeI2固体 | 反应后溶液变黄 | 反应后溶液中存在大量Fe3+ |
C | 取3mL1 mol·L-1NaOH溶液,先加入3滴1 mol·L-1 MgCl2溶液,再加入3滴1 mol·L-1FeCl3溶液 | 出现红褐色沉淀 | Mg(OH)2的Ksp比Fe(OH)3的Ksp大 |
D | 常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色更深 | 结合质子的能力:CO32->HCO3- |
A. AB. BC. CD. D







