题目内容
【题目】(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为________。
(2)2-巯基烟酸(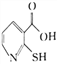 )水溶性优于2–巯基烟酸氧钒配合物(
)水溶性优于2–巯基烟酸氧钒配合物(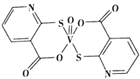 )的原因是___________________________________________________________________。
)的原因是___________________________________________________________________。
(3)各原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________。
A.SO2 B.SO42- C.H2S D.CS2
(4)尿素(H2NCONH2)尿素分子中,原子杂化轨道类型有________,σ键与π键数目之比为________。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如左下图)和六方氮化硼(如右下图),前者类似于金刚石,后者与石墨相似。
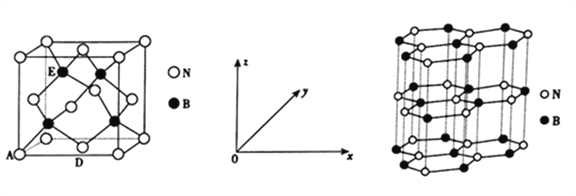
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。左上图中原子坐标参数A为(0,0,0),D为(![]() ,
,![]() ,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(
,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(![]() =1.732)。
=1.732)。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的计算表这式为________pm。(已知正六边形面积为![]() a2,a为边长)
a2,a为边长)
【答案】![]() 2-巯基烟酸的羧基可与水分子之间形成氢鍵,使其在水中溶解度增大 AD sp2、sp3 7∶1 (
2-巯基烟酸的羧基可与水分子之间形成氢鍵,使其在水中溶解度增大 AD sp2、sp3 7∶1 (![]() ,
,![]() ,
,![]() ) 156.5
) 156.5 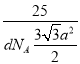 ×1010
×1010
【解析】
(1)考查轨道式的书写,Cu属于副族元素,价电子应是最外层电子和次外层d能级上的电子,因此Cu2+的价层电子的轨道式是![]() ;(2)考查溶解性,2-巯基烟酸的羧基可与水分子之间形成氢鍵,使其在水中溶解度增大;(3)考查化学键类型,A、SO2中心原子S有2个σ键,孤电子对数为(6-2×2)/2=1,价层电子对数为3,则SO2空间构型为V型,符合题中所给条件,即存在离域π键,故A正确;B、SO42-中心原子S含有4个σ键,孤电子对数为(6+2-4×2)/2=0,价层电子对数为4,空间构型为正四面体,不符合题中信息,不含离域π键,故B错误;C、H2S的空间构型为V型,但H不含p能级,即不存在离域π键,故C错误;D、CS2空间构型为直线型,符合信息,存在离域π键,故D正确;(4)考查杂化类型的判断、化学键数目的判断,尿素的结构简式为
;(2)考查溶解性,2-巯基烟酸的羧基可与水分子之间形成氢鍵,使其在水中溶解度增大;(3)考查化学键类型,A、SO2中心原子S有2个σ键,孤电子对数为(6-2×2)/2=1,价层电子对数为3,则SO2空间构型为V型,符合题中所给条件,即存在离域π键,故A正确;B、SO42-中心原子S含有4个σ键,孤电子对数为(6+2-4×2)/2=0,价层电子对数为4,空间构型为正四面体,不符合题中信息,不含离域π键,故B错误;C、H2S的空间构型为V型,但H不含p能级,即不存在离域π键,故C错误;D、CS2空间构型为直线型,符合信息,存在离域π键,故D正确;(4)考查杂化类型的判断、化学键数目的判断,尿素的结构简式为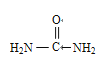 ,判断出N、C、O杂化类型分别是sp3、sp2、sp3;成键原子之间只能形成1个σ键,因此1mol尿素中含有σ键的物质的量为7mol,含有π键的物质的量为1mol,比值为7:1;(5)考查晶胞的计算,①BN结构类似于金刚石的结构,因此BN为原子晶体,根据金刚石晶胞结构贴点,E的坐标为(1/4,3/4,3/4);立方氮化硼中B和N最近的距离是体对角线的1/4,求出B与N之间的距离应是
,判断出N、C、O杂化类型分别是sp3、sp2、sp3;成键原子之间只能形成1个σ键,因此1mol尿素中含有σ键的物质的量为7mol,含有π键的物质的量为1mol,比值为7:1;(5)考查晶胞的计算,①BN结构类似于金刚石的结构,因此BN为原子晶体,根据金刚石晶胞结构贴点,E的坐标为(1/4,3/4,3/4);立方氮化硼中B和N最近的距离是体对角线的1/4,求出B与N之间的距离应是![]() pm(x为晶胞的边长),即为156.5pm;②根据六方氮化硼的结构,B的个数为6×1/6+3×1/3=2,晶胞的质量为
pm(x为晶胞的边长),即为156.5pm;②根据六方氮化硼的结构,B的个数为6×1/6+3×1/3=2,晶胞的质量为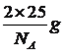 ,根据晶胞的体积为(
,根据晶胞的体积为(![]() a2×h)cm3(h为六方氮化硼的高),根据晶胞的密度的定义,求出h=2×
a2×h)cm3(h为六方氮化硼的高),根据晶胞的密度的定义,求出h=2×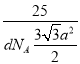 cm,层与层之间的距离应是高的一半,因此
cm,层与层之间的距离应是高的一半,因此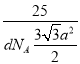 ×1010pm。
×1010pm。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案