题目内容
一定温度下,反应2SO2+O2A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
解析:缩小体积时,压强增大,平衡向右移动,设达新平衡时SO2转化的物质的量是x,而原平衡中三者物质的量分别是2a、3a、4a。
2SO2 + O2 ![]() 2SO3
2SO3
原平衡/mol 2a 3a 4a
转化/mol x ![]() x
x
新平衡/mol2a-x 3a-![]() 4a+x
4a+x
3a-![]() =0.8 mol 4a+x=1.4 mol
=0.8 mol 4a+x=1.4 mol
解得a=0.3 mol x=0.2 mol
n(SO2)=2×0.3 mol-0.2 mol=0.4 mol。
答案:A

练习册系列答案
相关题目
Ⅰ.在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为 反应(填“吸热”或“放热”)。
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L,c(H2O) =" 0.03" mol/L,c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO
 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
 如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)
如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)
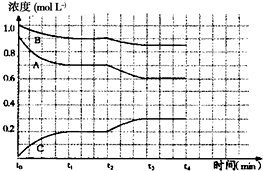 有如下化学反应:2A(g)+B(g)?2C(g),△H<0.
有如下化学反应:2A(g)+B(g)?2C(g),△H<0.