题目内容
Ⅰ.在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为 反应(填“吸热”或“放热”)。
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L,c(H2O) =" 0.03" mol/L,c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO
 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(11分)Ⅰ (1)吸热 (2)小
Ⅱ.(1)<;(2)1.88×10-4 mol·L-1·s-1;(3)5000;(4)C、D;(5向左;不改变
解析试题分析:Ⅰ. (1)根据表中数据可知,随着温度的升高,平衡常数K逐渐增大,这说明升高温度平衡向正反应方向移动,所以该反应为吸热反应。
(2)如果始浓度为c(CO) =" 0.01" mol/L,c(H2O) =" 0.03" mol/L,c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则此时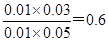 。由于800℃时K=1.0,所以此时反应向正反应方向进行,即H2O的消耗速率比生成速率小。
。由于800℃时K=1.0,所以此时反应向正反应方向进行,即H2O的消耗速率比生成速率小。
Ⅱ.(1)自发反应,通常为放热反应,即DH小于0。
(2)以NO计算,2s内NO的浓度变化为(10-2.5)×10-4mol/L,V(NO)=7.5×10-4/2 =3.75×10-4mol/(L·s)。根据速率之比等于计量系数比可知,V(N2)=1/2 V(NO)=1.875×0-4mol/(L·s)。
(3)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知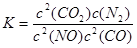 =
=
 =5000。
=5000。
(4)催化剂不影响平衡的移动,A项错;该反应放热,所以社会稳定平衡逆向移动,NO转化率降低,B项错,C项正确;缩小体积,即增大压强,平衡向体积减小的方向运动,即正向移动,D项正确,答案选CD。
(5)若在恒温、恒压条件下向平衡体系中通入氩气,则容积的体积必然增大,平衡向左移动。催化剂不能改变反应热,所以使用催化剂,上述反应的△H不变。
考点:考查外界条件对平衡状态的影响、平衡常数的判断和计算以及反应速率和反应热的计算
点评:该题是高考中的常见题型,试题综合性强,对学生的要求较高。试题在注重对学生基础知识巩固的训练的同时,更侧重对学生能力的培养和解题方法的指导与训练,有利于调动学生的学习兴趣和学习积极性,激发学生的学习求知欲。也有助于培养学生的逻辑推理能力和抽象思维能力。

| A、平衡混合气中A或C的体积分数 | B、平衡混合气的密度 | C、平衡时,A或B的转化率 | D、平衡时,C的物质的量浓度 |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、该反应的焓变为△H<0 |
| B、830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡向逆反应方向移动 |
| C、若1200℃时,某时刻体系中CO2、H2、CO、H2O的浓度分别为2 mol?L-1、2 mol?L-1、4 mol?L-1、4 mol?L-1,则此时v逆<v正 |
| D、若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,CO转化率为83.3% |
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题: (2012?成都模拟)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
(2012?成都模拟)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0