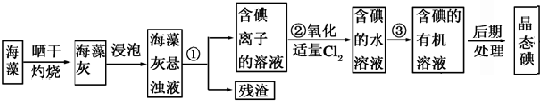
题目内容
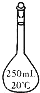
欲配制100mL1.0mol?L-1Na2SO4溶液,正确的方法是( )
①将14.2gNa2SO4溶于100mL水中
②将32.2gNa2SO4?10H2O溶于少量水中,再用水稀释至100mL
③将20mL5.0mol?L-1Na2SO4溶液用水稀释至100mL.
①将14.2gNa2SO4溶于100mL水中
②将32.2gNa2SO4?10H2O溶于少量水中,再用水稀释至100mL
③将20mL5.0mol?L-1Na2SO4溶液用水稀释至100mL.
| A.①② | B.②③ | C.①③ | D.①②③ |
①14.2gNa2SO4的物质的量为
=0.1mol,溶液的体积不等于溶剂的体积,所以无法计算出物质的量浓度,故①错误;
②32.2gNa2SO4?10H2O物质的量为
=0.1mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,硫酸钠的物质的量浓度c=
=1.0mol?L-1,故②正确;
③根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,则20ml×5mol/L=100ml×c(硫酸钠),则c(硫酸钠)=1mol/L,故③正确.
故选:B;
| 14.2g |
| 142g/mol |
②32.2gNa2SO4?10H2O物质的量为
| 32.2g |
| 322g/mol |
| 0.1mol |
| 0.1L |
③根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,则20ml×5mol/L=100ml×c(硫酸钠),则c(硫酸钠)=1mol/L,故③正确.
故选:B;

练习册系列答案
相关题目