题目内容
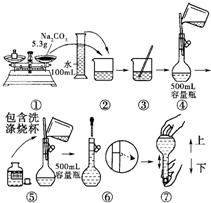
某同学用氯化钠固体配制0.04mol/L的NaCl溶液500mL,设计了如下的操作步骤:A:计算;B:称量;C:洗涤转移;D:定容摇匀;E:溶液转移
回答下列问题
(1)实验中需要称量NaCl固体______g;称量时NaCl固体应该放在托盘天平的______盘.
(2)上述操作步骤的正确顺序是(添字母代号)______;
为保证实验的正常进行,所需仪器除了容量瓶(500mL规格)、托盘天平、量筒外,还要需要的实验仪器有:______.
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因.
①为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容.对所配溶液浓度的影响是______(选填“偏低”或“偏高”或“无影响”),原因是______.
②定容后,加盖倒转摇匀后,发现溶液面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响是______(选填“偏低”或“偏高”或“无影响”),原因是______.
回答下列问题
(1)实验中需要称量NaCl固体______g;称量时NaCl固体应该放在托盘天平的______盘.
(2)上述操作步骤的正确顺序是(添字母代号)______;
为保证实验的正常进行,所需仪器除了容量瓶(500mL规格)、托盘天平、量筒外,还要需要的实验仪器有:______.
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因.
①为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容.对所配溶液浓度的影响是______(选填“偏低”或“偏高”或“无影响”),原因是______.
②定容后,加盖倒转摇匀后,发现溶液面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响是______(选填“偏低”或“偏高”或“无影响”),原因是______.
(1)配制0.04mol/L的NaCl溶液500mL,n(NaCl)=0.04mol/L×0.5L=0.02mol,需要氯化钠的质量为:m(NaCl)=58.5g/mol×0.02mol=1.17g;
根据左物右码原则,称量时NaCl固体应该放在托盘天平的左盘,
故答案为:1.17;左;
(2)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以操作步骤的正确顺序是:A、B、E、C、D;使用的仪器为:药匙、托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少烧杯、玻璃棒、胶头滴管,
故答案为:A、B、E、C、D;烧杯、玻璃棒、胶头滴管;
(3)①在未降至室温时,立即将溶液转移至容量瓶定容,热的溶液体积偏大,冷却后溶液体积偏小,导致配制的溶液浓度偏高,
故答案为:偏大;溶液未冷却,导致定容时加水不足;
②定容后,加盖倒转摇匀后,发现溶液面低于刻度线,属于正常现象,不需要加入蒸馏水,若又滴加蒸馏水至刻度,导致配制的溶液体积偏大,溶液浓度偏小,
故答案为:偏小;倒转摇匀中部分溶液附在容量瓶颈部,故出现溶液液面低于刻度线,若再加水,会使溶液过多.
根据左物右码原则,称量时NaCl固体应该放在托盘天平的左盘,
故答案为:1.17;左;
(2)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以操作步骤的正确顺序是:A、B、E、C、D;使用的仪器为:药匙、托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少烧杯、玻璃棒、胶头滴管,
故答案为:A、B、E、C、D;烧杯、玻璃棒、胶头滴管;
(3)①在未降至室温时,立即将溶液转移至容量瓶定容,热的溶液体积偏大,冷却后溶液体积偏小,导致配制的溶液浓度偏高,
故答案为:偏大;溶液未冷却,导致定容时加水不足;
②定容后,加盖倒转摇匀后,发现溶液面低于刻度线,属于正常现象,不需要加入蒸馏水,若又滴加蒸馏水至刻度,导致配制的溶液体积偏大,溶液浓度偏小,
故答案为:偏小;倒转摇匀中部分溶液附在容量瓶颈部,故出现溶液液面低于刻度线,若再加水,会使溶液过多.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目