题目内容
11.下列物质中,可以形成酸雨的是( )| A. | 甲烷 | B. | 氟氯代烃 | C. | 二氧化碳 | D. | 二氧化硫 |
分析 酸雨是工业高度发展而出现的副产物,由于人类大量使用煤、石油、天然气等化石燃料,燃烧后产生的硫氧化物或氮氧化物,在大气中经过化学反应,形成硫酸或硝酸,随雨水降到地面成为酸雨,据此进行判断.
解答 解:酸雨是指pH小于5.6的降水,主要是由于人为排放的硫氧化物和氮氧化物等酸性气体转化而成的,我国主要以硫酸型酸雨为主,这是由于我国以煤炭为主的能源结构造成的,因此选项D正确,
故选D.
点评 本题考查了酸雨的成因,题目难度不大,明确酸雨的概念及形成原因为解答关键,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
1.草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如表:
(1)为证明草酸受热分解的产物中含有CO2和CO(部分夹持仪器和加热装置省略),某课题小组设计实验如下:
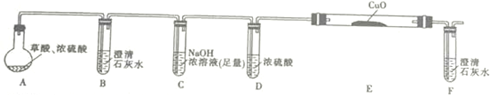
①写出E中反应的化学方程式并用双线桥标明电子转移的方向和数目: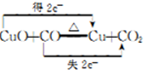 .
.
②用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,请你提出改进意见:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
③利用改进后的装置进行实验时,要先加热A(填“A”“B”“C”“D”“E”或“F”,下同)装置,后加热E装置.
(2)该小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需的时间来判断反应的快慢.该小组设计了如下方案:
①已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5(或5:2).
②探究温度对化学反应速率影响的实验编号是Ⅱ和Ⅲ;探究反应物浓度对化学反应速率影响的实验编号是I和Ⅱ.
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O,草酸钙和草酸氢钙均为白色不溶物 |

①写出E中反应的化学方程式并用双线桥标明电子转移的方向和数目:
 .
.②用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,请你提出改进意见:在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
③利用改进后的装置进行实验时,要先加热A(填“A”“B”“C”“D”“E”或“F”,下同)装置,后加热E装置.
(2)该小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需的时间来判断反应的快慢.该小组设计了如下方案:
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
②探究温度对化学反应速率影响的实验编号是Ⅱ和Ⅲ;探究反应物浓度对化学反应速率影响的实验编号是I和Ⅱ.
6.下列关于SO2的叙述,正确的是( )
| A. | SO2与水反应生成硫酸 | |
| B. | 我国大气中SO2的主要来源是汽车排出的尾气 | |
| C. | SO2能漂白某些物质如品红溶液,说明它具有氧化性 | |
| D. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 |
16.据最新报道:我国限塑3年,少用240亿个塑料袋.下列有关说法错误的是( )
| A. | 限塑的主要意义是减少白色污染 | |
| B. | 塑料袋的材料主要是聚乙烯、聚氯乙烯等 | |
| C. | 聚乙烯、聚氯乙烯等塑料都是天然高分子材料 | |
| D. | 聚乙烯是由乙烯分子通过加成反应聚合而成 |
1.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用,下表列出了①~⑩10种元素在周期表中位置.
请回答:
(1)这10种元素其中化学性质最不活泼的是Ar,非金属性最强的是F,形成化合物种类最多的是C(填元素符号);
(2)第三周期列出的六种元素对应的最简离子中半径最大的是S2-,最小的是Al3+(填离子符号);
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O;
在⑤、⑦、⑧三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式);
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为HF>HCl>H2S,还原性最强是H2S(填化学式);
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是H2O或CH4(举一例即可,填化学式);
(6)用电子式表示①与⑦形成化合物的形成过程 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
(1)这10种元素其中化学性质最不活泼的是Ar,非金属性最强的是F,形成化合物种类最多的是C(填元素符号);
(2)第三周期列出的六种元素对应的最简离子中半径最大的是S2-,最小的是Al3+(填离子符号);
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O;
在⑤、⑦、⑧三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式);
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为HF>HCl>H2S,还原性最强是H2S(填化学式);
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是H2O或CH4(举一例即可,填化学式);
(6)用电子式表示①与⑦形成化合物的形成过程
 .
. 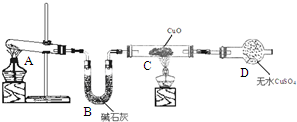 某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题:
某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题: (1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.
(1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.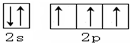 (2)Cl
(2)Cl .
. 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题: