题目内容
16.短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y与Z的原子最外层电子数之比为2:1.下列说法不正确的是( )| X | Y | ||
| Z |
| A. | X与Y可以形成多种化合物 | |
| B. | 简单离子的半径大小:Z<Y<X | |
| C. | X、Y、Z三种元素形成的化合物中既存在共价键又存在离子键 | |
| D. | 在X的最高氧化物对应水化物的浓溶液中加入Z单质,Z不溶解,说明未发生化学反应 |
分析 设Y的最外层电子数是x,则Z的最外层电子数是x-3,根据题意可得x=2(x-3),解得x=6,所以Y是O元素,X是N元素,Z是Al元素,以此解答该题.
解答 解:设Y的最外层电子数是x,则Z的最外层电子数是x-3,根据题意可得x=2(x-3),解得x=6,所以Y是O元素,X是N元素,Z是Al元素,
A.N与O可形成多种化合物,如N2O、NO、NO2、N2O4等,故A正确;
B.X、Y、Z形成的简单离子的电子层结构相同,核电荷数越大离子半径越小,故B正确;
C.由N、O、Al形成的化合物硝酸铝是离子化合物,既存在共价键又存在离子键,故C正确;
D.N的最高氧化物对应水化物的浓溶液具有强氧化性,加入Al单质,发生钝化反应,Al不溶解,故D错误.
故选D.
点评 本题考查元素周期表、原子结构、性质的关系应用,为高频考点,侧重于学生的分析能力的考查,难度不大,推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
6.下列说法正确的是( )
| A. | 钠的金属性比钾强 | |
| B. | 溴的非金属性比氯强 | |
| C. | IIA族中原子半径最小的是铍 | |
| D. | 第二周期中,除稀有气体元素外原子半径最大的是锂 |
11.下列说法正确的是( )
| A. | SO2与Na2SO3或NaHCO3溶液能发生反应 | |
| B. | SO2和CO2分别通入BaCl2和Ba(NO3)2溶液中都不产生沉淀 | |
| C. | 浓硫酸具有吸水性,因而能使蔗糖碳化 | |
| D. | SO2和O2混合加热,可生成三氧化硫 |
11.已知Na2SO4的化学式量为142,则500mL1.0mol•L-1 Na2SO4溶液含有溶质质量为( )
| A. | 35.5g | B. | 71g | C. | 119g | D. | 142g |
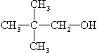 .
. 在一定条件下,N2(g)+H2(g)?2NH3(g),该反应的能量变化为放出92.4KJ热量,在容积为2升的密闭容器中,分别充入1molN2和1molH2,2min反应达到最大限度,三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
在一定条件下,N2(g)+H2(g)?2NH3(g),该反应的能量变化为放出92.4KJ热量,在容积为2升的密闭容器中,分别充入1molN2和1molH2,2min反应达到最大限度,三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: ,
, .
.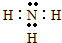 ,
,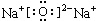 (或
(或 ).
).