题目内容
8.某烃分子中碳氢质量之比为24:5,则该烃的一氯代物中含有两个甲基的同分异构体的数目有2.(不考虑立体立构)分析 碳氢质量之比为24:5,则m(C)=12×n,m(H)=1×n,所以C:H的数目=2:5,即最简式为C2H5,应符合CnH2n+2,所以n:2n+2=2:5,n=4,其分子式为C4H10,
然后写出其一氯代物.
解答 解:碳氢质量之比为24:5,则m(C)=12×n,m(H)=1×n,所以C:H的数目=2:5,即最简式为C2H5,应符合CnH2n+2,所以n:2n+2=2:5,n=4,其分子式为C4H10,丁烷存在正丁烷和异丁烷两种同分异构体,正丁烷CH3CH2CH2CH3有2种氢原子,所以其一氯代物有2,即CH3CH2CH2CH2Cl和CH3CHClCH2CH3,异丁烷的一氯代物有两种,即CH2Cl-CH(CH3)2,(CH3)3CCl,所以含有两个甲基的同分异构体为CH3CHClCH2CH3和CH2Cl-CH(CH3)2,
故答案为:2.
点评 本题考查了物质的确定、同分异构体的判断,难度不大,先确定烃的同分异构体,再确定等效氢原子,最后根据氢原子的种类确定一氯代物的种类,会确定等效氢原子是解本题的关键.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
18.在制造玻璃和水泥都用到的原料是( )
| A. | 石灰石 | B. | 纯碱 | C. | 黏土 | D. | 石英 |
19.XYZW均为短周期元素,它们在元素周期表中的位置如右图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
| X | Y | |
| Z | W |
| A. | ZWXY的原子半径依次增大 | |
| B. | ZWXY的气态氢化物的稳定性依次减弱 | |
| C. | ZXY原子最外层电子数依次增多 | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
16.短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y与Z的原子最外层电子数之比为2:1.下列说法不正确的是( )
| X | Y | ||
| Z |
| A. | X与Y可以形成多种化合物 | |
| B. | 简单离子的半径大小:Z<Y<X | |
| C. | X、Y、Z三种元素形成的化合物中既存在共价键又存在离子键 | |
| D. | 在X的最高氧化物对应水化物的浓溶液中加入Z单质,Z不溶解,说明未发生化学反应 |
3.由两种气态烃组成的混合气体20mL,跟过量氧气混合后完全燃烧,当燃烧产物通过浓H2SO4,体积减少30mL,然后通过碱石灰,体积又减少40mL(气体均在相同条件下测得),则这两种烃可能为( )
| A. | CH4与C2H4 | B. | C2H2与C2H4 | C. | C2H2与C2H6 | D. | CH4与C2H6 |
13.下列说法正确的是( )
| A. | 可通过热还原法制备金属铝和铁 | |
| B. | 工业制硫酸产生的废气需用石灰水吸收 | |
| C. | 淀粉、植物油、蛋白酶均为高分子化合物 | |
| D. | 水晶、玛瑙、光导纤维、陶瓷的主要成分都是二氧化硅 |
5.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.一定条件下,现有容积相同且恒容的密闭容器甲与乙:①向甲中通入1mol N2和3mol H2,达到平衡时放出热量Q1kJ;②向乙中通入0.5mol N2和1.5mol H2,达到平衡时放出热量Q2 kJ.则下列关系式正确的是( )
| A. | Q1=2Q2=92.4 | B. | 92.4=Q1<2Q2 | C. | 92.4>Ql>2Q2 | D. | Q1=2Q2<92.4 |
3.某种兴奋剂的结构简式如图所示,有关该物质的说法中不正确的是( )
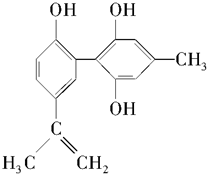

| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中不可能所有碳原子共平面 | |
| C. | 该物质能与浓溴水发生加成反应和取代反应 | |
| D. | 1 mol该物质在催化剂作用下最多能与7 molH2发生加成反应 |