题目内容
【题目】高铁酸钾是绿色、环保型水处理剂,也是高能电池的电极材料。工业上利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:

回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式______________。
(2)制备铁黄的离子方程式为_______________。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择_________;pH大于4.5时铁黄产率逐渐降低的主要原因可能是_______________。

(3)用高铁酸钾作水处理剂除了可以对水体进行杀菌消毒之外,其还原产物氢氧化铁胶体还能吸附水中悬浮杂质,请写出用高铁酸钾除去水体中CN﹣的离子方程式______。
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10﹣38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=_________molL﹣1。
(5)如果上述流程中,铁元素总利用率为75%。利用1L 2molL﹣1FeSO4溶液能制备纯度为90%的高铁酸钾________g。
【答案】 NaCl+H2O![]() NaClO+H2↑ 12Fe2++3O2+2H2O=4FeOOH+8Fe3+ 40℃ 酸性减弱,Fe (OH) 3增多 l0FeO42-+6CN-+22H2O=l0Fe (OH) 3 (胶体) +6CO32-+3N2↑+140H+ pH=2时, c(OH-) =10-12mol/L,根据 KspLFe(OH)3]=4.0×10-38,c (Fe3+)=0.04mol/L 330g
NaClO+H2↑ 12Fe2++3O2+2H2O=4FeOOH+8Fe3+ 40℃ 酸性减弱,Fe (OH) 3增多 l0FeO42-+6CN-+22H2O=l0Fe (OH) 3 (胶体) +6CO32-+3N2↑+140H+ pH=2时, c(OH-) =10-12mol/L,根据 KspLFe(OH)3]=4.0×10-38,c (Fe3+)=0.04mol/L 330g
【解析】(1)电解饱和食盐水制取次氯酸钠的化学方程式为NaCl+H2O![]() NaClO+H2↑;(2)硫酸亚铁与氧气反应生成铁黄(FeOOH)的反应中氧化剂为氧气,还原剂为硫酸亚铁,反应中铁的化合价由+2合成+3价,O元素的化合价由0价变成-2价,根据得失电子守恒,氧化剂和还原剂的物质的量之比为
NaClO+H2↑;(2)硫酸亚铁与氧气反应生成铁黄(FeOOH)的反应中氧化剂为氧气,还原剂为硫酸亚铁,反应中铁的化合价由+2合成+3价,O元素的化合价由0价变成-2价,根据得失电子守恒,氧化剂和还原剂的物质的量之比为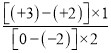 =
=![]() ,反应的离子方程式为12Fe2++3O2+2H2O=4FeOOH+8Fe3+。根据图像,40℃左右时,铁黄产率较高;pH大于4.5时生成了氢氧化铁,使得铁黄产率降低;(3)高铁酸钾具有氧化性,可以将CN-氧化为氮气和二氧化碳而除去,本身被还原为氢氧化铁胶体,在碱性溶液中二氧化碳变成碳酸根离子,反应的方程式为10FeO42-+6CN-+22H2O=10Fe(OH)3(胶体)+6CO32-+3N2↑+14OH-;(4)pH=2时,c(OH-)=10-12mol/L,根据Kap[Fe(OH)3]=4.0×10-38, c(Fe3+)=
,反应的离子方程式为12Fe2++3O2+2H2O=4FeOOH+8Fe3+。根据图像,40℃左右时,铁黄产率较高;pH大于4.5时生成了氢氧化铁,使得铁黄产率降低;(3)高铁酸钾具有氧化性,可以将CN-氧化为氮气和二氧化碳而除去,本身被还原为氢氧化铁胶体,在碱性溶液中二氧化碳变成碳酸根离子,反应的方程式为10FeO42-+6CN-+22H2O=10Fe(OH)3(胶体)+6CO32-+3N2↑+14OH-;(4)pH=2时,c(OH-)=10-12mol/L,根据Kap[Fe(OH)3]=4.0×10-38, c(Fe3+)= mol/L=0.04mol/L;
mol/L=0.04mol/L;
(5)1L 2mol·L-1FeSO4溶液中含有2mol FeSO4,根据铁元素守恒,生成高铁酸钾的质量=2mol×75%×198g/mol÷90%=330g。











