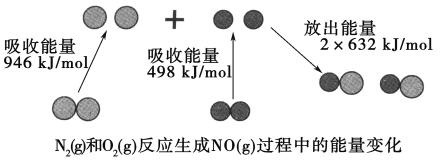
题目内容
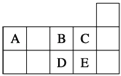
【题目】下列物质按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合中,正确的是( )
强电解质 | 弱电解质 | 酸性氧化物 | 碱性氧化物 | |
A | H2SO4 | CH3COOH | NO2 | Na2O |
B | BaSO4 | HClO | Mn2O7 | CaO |
C | NaCl | 氨水 | SO2 | MnO2 |
D | HI | HF | CO2 | Fe3O4 |
【答案】B
【解析】
试题分析:A.NO2不属于酸性氧化物,故A错误;B.硫酸钡属于强电解质,次氯酸属于弱电解质,七氧化二锰属于酸性氧化物,氧化钙属于碱性氧化物,故B正确;C.氨水为混合物,不属于弱电解质,故C错误;D.四氧化三铁不属于碱性氧化物,故D错误。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】一个化学反应,我们不但要关心物质变化,还要研究能量变化和反应快慢。
(1)下面是一个由天然气和水反应制备氢气的反应,其方程式为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
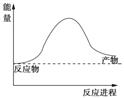
若已知,破坏1mol化学键需要吸收的热量如下表所示:则该反应吸收或放出热量为______kJ (用含a b c d字母的代数式表示)。
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |
(2)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。