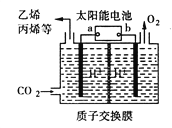
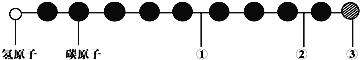
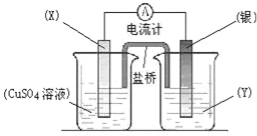
题目内容
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )

A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
C.在1 L的容器中发生反应,10 min内 N2 减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol/(L·min)
D.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
【答案】D
【解析】
试题分析:A.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2=2NO,△H=946KJ/mol+498KJ/mol-2×632KJ/mol=180KJ/mol,反应是吸热反应,故A错误;B.一氧化氮不能和氢氧化钠反应,不是酸性氧化物,故B错误;C.在1 L的容器中发生反应,10 min内 N2 减少了1 mol,10 min内的平均反应速率为v(N2)=0.1 mol/(L·min),则v(NO)=0.2 mol/(L·min),故C错误;D.依据A计算可知反应是吸热反应,依据能量守恒,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故D正确;答案为D。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
【题目】下列物质按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合中,正确的是( )
强电解质 | 弱电解质 | 酸性氧化物 | 碱性氧化物 | |
A | H2SO4 | CH3COOH | NO2 | Na2O |
B | BaSO4 | HClO | Mn2O7 | CaO |
C | NaCl | 氨水 | SO2 | MnO2 |
D | HI | HF | CO2 | Fe3O4 |