题目内容
下列说法不正确的是
| A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
B.0.1mol 的NaHCO3溶液中 的NaHCO3溶液中 |
C.0.1mol 的NaHA溶液Ph=5,则溶液: 的NaHA溶液Ph=5,则溶液: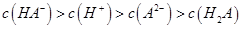 |
D.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液 |
B
解析试题分析:A、.将pH=4的某酸稀释10倍,若pH=5为强酸,pH<5为弱酸,故A正确;B、溶液存在电荷守恒,即c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故B错误;C、由物料守恒可知c(Na+)=c(HA-)+c(A2-)+c(H2A),由电荷守恒可知c(Na+ )+c(H+)=c(OH- )+c( HA-)+2c(A2-),即c(HA-)>c(H+)>c(A2-)>c(H2A),故C正确;D、醋酸跟离子水解产生H+,使溶液pH降低,故D正确。
考点:弱电解质在水中的电离平衡;离子浓度大小的比较;盐类水解

练习册系列答案
相关题目
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
| A.白色沉淀为ZnS,黑色沉淀为CuS |
| B.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| C.上述现象说明ZnS的Ksp小于CuS的Ksp |
| D.该过程破坏了ZnS的溶解平衡 |
右图是用0.1000 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是
| A.水电离出的氢离子浓度:a>b |
| B.盐酸的物质的量浓度为0.0100 mol·L-1 |
| C.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| D.当滴加NaOH溶液10.00 mL时,该混合液的pH=1+lg3 |
下列说法正确的是
| A.电解质溶液能导电,是因为在通电时电解质电离产生了自由移动的离子 |
| B.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变 |
| C.将AlCl3溶液和Na2SO3溶液分别蒸干并灼烧,得到Al2O3和Na2SO3 |
| D.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,则溶液浓度大小关系: |
在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是
| A.a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D.d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
下列叙述或表示正确的是( )
| A.常温下pH均为3的醋酸和硫酸的水溶液,分别加水稀释100倍后,两种溶液的pH仍相同 |
| B.氢氧化钙溶液中加入过量的碳酸氢钙溶液的离子方程式:Ca2+ + HCO3—+OH— = CaCO3 ↓+ H2O |
| C.Ksp反映了难熔电解质在水中的溶解能力,它的大小与浓度无关,与温度无关。 |
| D.c(H+)=1×10-2 mol·L的溶液:Fe2+、Ba2+、N03-、Cl-不能大量共存。 |
室温下,下列关于pH均为9、体积均为10 mL的NaOH溶液和CH3COONa溶液的说法,正确的是
| A.两种溶液中的c(Na+)相等 |
| B.分别加热到相同温度时,CH3COONa溶液的pH小 |
| C.分别加水稀释到100 mL时,两种溶液的pH依然相等 |
| D.两溶液中由水电离出的c(OH-)之比为10-9/10-5 |
下列微粒对CH3COO- + H2O CH3COOH + OH-水解平衡有影响的是
CH3COOH + OH-水解平衡有影响的是
| A.H3O+ | B. | C.NO3- | D.Ba2+ |
下列溶液中各微粒的浓度关系正确的是
| A.0.1 mol·L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-] |
| B.0.1 mol·L-1Na2S溶液中:2[Na+]=[S2-]+[HS-]+[H2S] |
| C.0.1 mol·L-1 NaHCO3溶液中:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-] |
| D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-] |