题目内容
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
| A.白色沉淀为ZnS,黑色沉淀为CuS |
| B.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| C.上述现象说明ZnS的Ksp小于CuS的Ksp |
| D.该过程破坏了ZnS的溶解平衡 |
C
解析试题分析:A、硫酸锌与硫化钠反应生成白色沉淀硫化锌和硫酸钠。由于硫化铜的溶解度小于硫化锌的溶解度,因此向白色沉淀中滴加CuSO4溶液,沉淀转化为更难溶的硫化铜黑色沉淀,A正确;B、根据沉淀容易转化为更难溶的沉淀可知,利用该原理可实现一种沉淀转化为更难溶的沉淀,B正确;C、上述现象说明ZnS的Ksp大于CuS的Ksp,C不正确;D、硫化锌转化为硫化铜,说明破坏了硫化锌的溶解平衡,D正确,答案选C。
考点:考查溶解平衡的有关判断与应用

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25℃时,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法正确的是
A.①稀释到原来的100倍后,pH与②相同
B.等体积①③混合、等体积②④混合所得的溶液都呈酸性
C.①②中分别加入少量CH3COONa固体,
 的值都变小
的值都变小D.将20mL的①溶液与10mL的③溶液混合后,若溶液呈碱性,则:c(NH4+) >c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
下列关于电离平衡常数(K)的说法中正确的是
| A.电离平衡常数(K)越小,表示弱电解质电离能力越弱 |
| B.电离平衡常数(K)与温度无关 |
| C.不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
| D.多元弱酸各步电离平衡常数相互关系为:K1<K2<K3 |
对水的电离平衡不产生影响的粒子是
| A.Al3+ | B.H+ | C.OH- | D.NO3- |
下列各溶液中,物质的量浓度关系正确的是
| A.0.1 mol?L—1的KAl(SO4)2溶液中:c(SO42—)>c(K+)>c(A13+)>c(H+)>c(OH—) |
| B.10mL0.01mo1?L—1HCl溶液与10mL0.01mo1?L—1Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12 |
| C.在01mo1?L—1CH3COONa溶液中,c(OH—)=c(CH3COOH)+c(H+) |
| D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液,若溶液呈酸性,则有c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—) |
有甲、乙、丙三瓶等体积、等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水(设溶质未变);乙中通入一定量的CO2;丙不做任何改变进行对照,以甲基橙作指示剂,用相同浓度的盐酸滴定,分别达到终点消耗盐酸的体积是
| A.V甲>V乙=V丙 | B.V甲>V丙>V乙 |
| C.V甲=V乙>V丙 | D.V甲=V乙=V丙 |
25℃时对于pH=1的盐酸,下列叙述不正确的是
| A.c(H+)=c(Cl-)+c(OH-) |
| B.c(H+)·c(OH-)=1.0×10—14 |
| C.由水电离出的c(H+)=1.0×10-13mol?L-1 |
| D.与pH=13的NaOH溶液混合后,混合溶液一定呈中性 |
下列说法不正确的是
| A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
B.0.1mol 的NaHCO3溶液中 的NaHCO3溶液中 |
C.0.1mol 的NaHA溶液Ph=5,则溶液: 的NaHA溶液Ph=5,则溶液: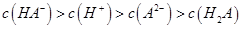 |
D.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液 |