题目内容
右图是用0.1000 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是
| A.水电离出的氢离子浓度:a>b |
| B.盐酸的物质的量浓度为0.0100 mol·L-1 |
| C.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| D.当滴加NaOH溶液10.00 mL时,该混合液的pH=1+lg3 |
D
解析试题分析:A、a点时加入NaOH较少,盐酸过量,溶液中c(H+)较大,c(H+)越大,水的电离程度越小,因此有水电离出的氢离子浓度:a<b,故A错误;B、加入NaOH溶液20.00mL时,酸碱恰好中和,由c(酸)×V(酸)=c(碱)×V(碱)可知,盐酸的物质的量浓度为0.1000 mol?L-1,故B错误;C、指示剂为酚酞,溶液变色范围为8.2~10,溶液呈碱性,NaOH过量,并不是恰好完全反应,故C错误;D、当滴加NaOH溶液10.00 mL时,盐酸过量,则此时溶液中c(H+)=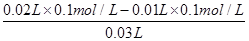 =
=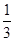 ×10-1mol/L,则pH=1+lg3,故D正确,答案选D。
×10-1mol/L,则pH=1+lg3,故D正确,答案选D。
考点:考查酸碱中和反应的有关判断和计算以及图像识别

练习册系列答案
相关题目
下列关于电离平衡常数(K)的说法中正确的是
| A.电离平衡常数(K)越小,表示弱电解质电离能力越弱 |
| B.电离平衡常数(K)与温度无关 |
| C.不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
| D.多元弱酸各步电离平衡常数相互关系为:K1<K2<K3 |
有甲、乙、丙三瓶等体积、等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水(设溶质未变);乙中通入一定量的CO2;丙不做任何改变进行对照,以甲基橙作指示剂,用相同浓度的盐酸滴定,分别达到终点消耗盐酸的体积是
| A.V甲>V乙=V丙 | B.V甲>V丙>V乙 |
| C.V甲=V乙>V丙 | D.V甲=V乙=V丙 |
25℃时对于pH=1的盐酸,下列叙述不正确的是
| A.c(H+)=c(Cl-)+c(OH-) |
| B.c(H+)·c(OH-)=1.0×10—14 |
| C.由水电离出的c(H+)=1.0×10-13mol?L-1 |
| D.与pH=13的NaOH溶液混合后,混合溶液一定呈中性 |
实验表明,相同温度下,液态纯硫酸的导电性强于纯水。下列关于相同温度下纯硫酸的离子积常数K和水的离子积常数Kw关系的描述正确的是
| A.K> Kw | B.K= Kw | C.K< Kw | D.无法比较 |
短周期元素W、X、Y、Z的原子序数依次增大,它们的简单离子中都能破坏水的电离的组合是
| A.Y3+、W- | B.Z2-、X+ | C.X+、Y3+ | D.X+、Z2- |
25℃,有c(CH3COOH)+c(CH3COO-)="0.1" mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。有关离子浓度关系分析正确的是
| A.pH=5.5溶液中:c(CH3COO-) >c(CH3COOH)>c(H+)>c(OH-) |
| B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.pH=3.5溶液中:c(Na+)-c(OH-)+c(CH3COOH)="0.1" mol/L |
| D.向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
下列说法不正确的是
| A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
B.0.1mol 的NaHCO3溶液中 的NaHCO3溶液中 |
C.0.1mol 的NaHA溶液Ph=5,则溶液: 的NaHA溶液Ph=5,则溶液: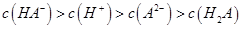 |
D.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液 |
下列叙述正确的是
| A.NaHCO3溶液中:c(H+) + c(Na+)=c(HCO3-)+2c(CO32-) + c(OH-) |
| B.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)一样多 |
| C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D.向10 mL 0.10mol?L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |