题目内容
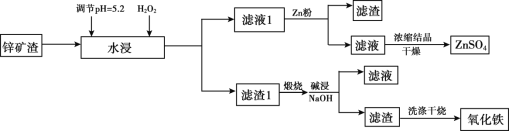
【题目】已知锌矿渣中含有ZnSO4、FeS2、SiO2、FeSO4、CuSO4 等,利用锌矿渣生产硫酸锌和氧化铁流程如下:
4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
已知:i.FeS2不溶于水和稀酸。
ii.金属离子氢氧化物开始沉淀和沉淀完全时的pH
氢氧化物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 6.5 | 7.5 | 2.2 |
沉淀完全时的pH | 8.5 | 9.5 | 3.5 |
iii.SiO2难溶于水,可溶于强碱生成一种可溶性盐。
(1)加入H2O2的目的是________。
(2)检验滤液1中不含Fe3+的方法是________,滤液1加入锌粉的作用是_____________(用离子方程式表示)。
(3)滤渣1的成分主要有 _________(写化学式),加入NaOH碱浸时反应的离子方程式是__________。
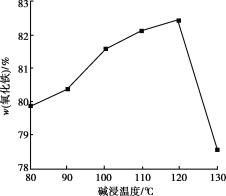
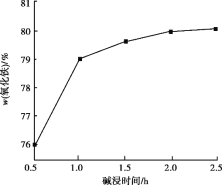
(4)用NaOH进行碱浸时,氧化铁含量与碱浸温度、碱浸时间关系如图所示,碱浸的最佳温度和时间为__________。
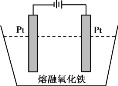
(5)传统钢铁冶炼高耗能、高污染,科学家寻找绿色环保的钢铁冶炼技术,通过电解的方法将铁矿石中的氧化铁(熔融态)变成金属铁。电解的示意图如图所示,请在图中标出两极名称及离子运动方向___________,并写出阴极电极反应式_______。
【答案】氧化Fe2+为Fe(OH)3而沉淀 取少量滤液1于试管中,滴加KSCN溶液,若不显红色,则证明不含Fe3+ Zn+Cu2+= Zn2++Cu SiO2 、Fe(OH)3 、FeS2 SiO2+2OH-=SiO32-+H2O 120℃1h 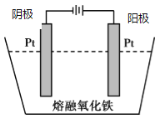 阴极:Fe3++3e-=Fe
阴极:Fe3++3e-=Fe
【解析】
锌矿渣中含有ZnSO4、FeS2、SiO2、FeSO4、CuSO4等,充分水浸,加入过氧化氢可将亚铁离子氧化,调节溶液pH=5.2可生成氢氧化铁沉淀,过滤,滤液1主要含有ZnSO4、CuSO4,加入锌粉置换出铜,滤液经蒸发浓缩可得硫酸锌;滤渣1主要含有SiO2、Fe(OH)3、FeS2(题目所给信息:FeS2不溶于水和稀酸),煅烧时发生反应4FeS2+11O2  2Fe2O3+8SO2、2Fe(OH)3
2Fe2O3+8SO2、2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O![]() ;煅烧后加入氢氧化钠溶液碱浸,SiO2与氢氧化钠溶液反应,可生成硅酸钠形成溶液,过滤得到的滤渣则主要为氧化铁,洗涤干燥后得到氧化铁,以此解答该题。
;煅烧后加入氢氧化钠溶液碱浸,SiO2与氢氧化钠溶液反应,可生成硅酸钠形成溶液,过滤得到的滤渣则主要为氧化铁,洗涤干燥后得到氧化铁,以此解答该题。
(1)加入H2O2,调节pH,可氧化Fe2+为Fe(OH)3而沉淀,故答案为:氧化Fe2+为Fe(OH)3而沉淀;
(2)铁离子与KSCN反应,检验滤液1中不含Fe3+的方法是取少量滤液1于试管中,滴加KSCN溶液,若不显红色,则证明不含Fe3+,滤液1加入锌粉可置换出铜,发生Zn+Cu2+=Zn2++Cu,
故答案为:取少量滤液1于试管中,滴加KSCN溶液,若不显红色,则证明不含Fe3+;Zn+Cu2+=Zn2++Cu;
(3)由以上分析可知滤渣1为SiO2、Fe(OH)3、FeS2,加入NaOH碱浸时反应的离子方程式是SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2、Fe(OH)3、FeS2;SiO2+2OH-=SiO32-+H2O;
(4)由图象可知,温度为120℃时氧化铁的含量最高,碱浸1h时氧化铁含量较高,且之后上升不明显,故答案为:120℃、1h;
(5)电解时,氧离子向阳极移动,铁离子向阴极移动,阴极发生还原反应生成铁,电极反应式为Fe3++3e-=Fe,图象可表示为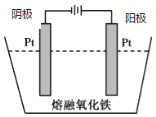 ,
,
故答案为: ;Fe3++3e-=Fe。
;Fe3++3e-=Fe。

 阅读快车系列答案
阅读快车系列答案【题目】根据下列表格中信息填写
有机物A | 有机物B | 有机物C | 有机物D |
1.该物质的产量是衡量一个国家石油化工水平的标志 2.比例模型: | 1.该物质为天然气的主要成分 2.比例模型: | 1.该物质由碳,氢,氧三种元素组成 2.75%的该物质的水溶液可做医用消毒剂 | 1.分子式为C2H4O2 2.该物质的水溶液显酸性,是家庭常用调味剂 |
(1)有机物A的结构简式为_________________,它与溴水反应的化学方程式为___________________。
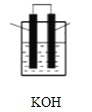
(2)有机物B的空间构型为_______________________将有机物B与氧气分别通入如图装置的两极组成燃料电池,该电池的负极反应为____________________________正极反应为_____________________________。
(3)有机物D在水溶液中的电离方程式为_______________________。 将pH=3的D溶液加水稀释10倍,所得溶液的pH_____4(填“大于”,“小于”),0.1molD与等量的NaOH溶液恰好完全反应的生成物显__________性(填“酸”或“碱”),该溶液中存在的电荷守恒关系式为_______________。


