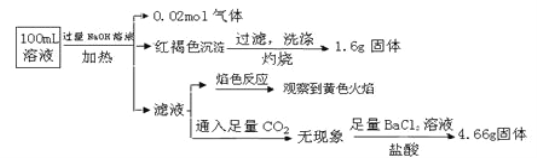
题目内容
【题目】铋为第五周期VA族元素,利用湿法冶金从辉铋矿(含Bi2S3、Bi、Bi2O3等)提取金属铋的工艺流程如下图所示:
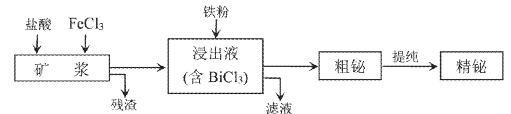
已知:BiCl3水解的离子方程式为:BiCl3+H2O![]() BiOCl+2H++2Cl-。
BiOCl+2H++2Cl-。
(1)矿浆浸出时加入盐酸的作用是___________。
(2)浸出时,Bi溶于FeCl3溶液的化学方程式为___________。
(3)残渣中含有一种单质,该单质是___________。
(4)滤液的主要溶质是(化学式)___________,该物质可在工艺中转化为循环利用的原料,转化的反应方程式为___________。
(5)精辉铋矿中含有Ag2S,被氧化溶解后不会进入浸出液,银元素以___________(填化学式)进入残渣中。
(6)粗铋提纯时,粗铋应放在___________极,阴极的电极反应式___________。
【答案】抑制BiCl3水解 Bi+3FeCl3=BiCl3+3FeCl2 S FeCl2 2FeCl2 +Cl2=2FeCl3 AgCl 阳 Bi3++3e-=Bi
【解析】
(1)矿浆浸出时溶液中BiCl3,BiCl3易发生水解,故加入HCl抑制BiCl3水解;
(2)浸出时,Bi溶于FeCl3发生氧化还原反应生成BiCl3和FeCl2;
(3)矿浆和HCl、FeCl3作用,负二价硫元素被氧化为S,所以生成硫单质;
(4)因在浸出液中加入Fe,所以Fe和BiCl3反应生成FeCl2和单质Bi,FeCl2溶液通入氯气将FeCl2氧化成FeCl3,转化为循环利用的原料FeCl3;
(5)在氧化溶解精辉铋矿的溶液中含有盐酸,所以银元素以AgCl形式进入残渣中;
(6)应用电解池原理进行粗铋提纯,粗铋做阳极,纯铋做阴极,溶液中的铋离子得到电子而析出;
(1)矿浆浸出液中BiCl3,BiCl3易发生水解,故加入HCl抑制BiCl3水解;
本题答案为:抑制BiCl3水解。
(2)浸出时,Bi溶于FeCl3发生氧化还原反应生成BiCl3和FeCl2,化学方程式为:Bi+3FeCl3=BiCl3+3FeCl2;
本题答案为:Bi+3FeCl3=BiCl3+3FeCl2。
(3)矿浆中Bi2S3和FeCl3反应时,负二价硫元素被氧化为S,所以生成硫单质;
本题答案为:S。
(4)因在浸出液中加入Fe,所以Fe和BiCl3反应生成FeCl2和单质Bi,故滤液的主要溶质是FeCl2,FeCl2转化为循环利用的FeCl3,化学方程式为:2FeCl2 +Cl2=2FeCl3;
本题答案为:FeCl2,2FeCl2 +Cl2=2FeCl3。
(5)精辉铋矿中含有Ag2S,被氧化溶解后不会进入浸出液,因为在氧化溶解精辉铋矿的溶液中含有大量的氯离子,所以银元素转化为难溶于水的AgCl进入残渣中;
本题答案为:AgCl。
(6)应用电解池原理进行粗铋提纯,粗铋做阳极,纯铋做阴极,溶液中的铋离子得到电子而析出;阴极电极反应式为:Bi3++3e-=Bi;
本题答案为:阳,Bi3++3e-=Bi。