题目内容
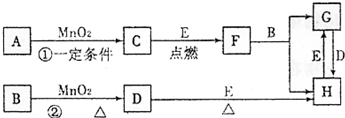
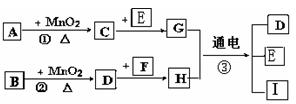
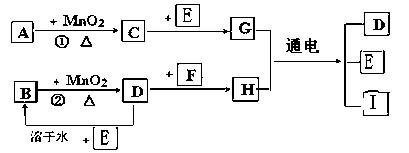
下图所涉及的物质均为中学化学中常见的物质,其中C、D、E为单质,其余为化合物,其中纳米F晶体材料可作为核磁共振造影增强剂,可用于疾病的诊断和药物载体,它们之间存在如下转化关系(部分产物已省略).
请回答下列问题:
(1)若反应①是在加热条件下进行的,则A是(填化学式)__________;若反应①是在常温条件下进行的,则A是____________________(填化学式);若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为____________________.
(2)H用途广泛如用作催化剂、印刷电路腐蚀剂和外伤止血剂及净水等.若将Cu棒与C棒用导线连接并插入H溶液中,可形成原电池,其中正极电极反应方程式为: ____________________.总离子方程式为:____________________.F与B反应的离子方程式为: ____________________.
(3)经测定A为二元弱酸,其酸性比碳酸弱,写出A在水溶液中的电离方程式: ____________________.A与氨气反应生成的酸式盐的化学式为:____________________.若将适量MnO2加入酸化后的A溶液中,MnO2溶解产生Mn2+,该反应的离子方程式为: ____________________.
(1)KClO3 H2O2 2:1
(2)2Fe3++2e-![]() 2Fe2+ 2Fe3++Cu
2Fe2+ 2Fe3++Cu![]() 2Fe2++Cu2+ Fe3O4+8H+
2Fe2++Cu2+ Fe3O4+8H+![]() 2Fe3++Fe2++4H2O
2Fe3++Fe2++4H2O
(3)H2O2![]() H++
H++![]() (
(![]()
![]() H++
H++![]() )
)
NH4HO2 MnO2+H2O2+2H+![]() Mn2++O2↑+2H2O
Mn2++O2↑+2H2O
解析:(1)MnO2所参与的反应有:催化分解KClO3、H2O2,实验室制Cl2,结合框图及问题中信息知:H为FeCl3,E为Fe,G为FeCl2,D为Cl2,B为盐酸,C为O2,若①在常温下进行,则A为H2O2,若①在加热下进行,则A为KClO3.
(3)H2O2为弱酸,第一步电离方程式为H2O2![]() H++
H++![]() ,NH3可以结合H+,使平衡正向移动;在酸性条件下H2O2将MnO2还原,同时本身被氧化产生O2,MnO2+H2O2+2H+
,NH3可以结合H+,使平衡正向移动;在酸性条件下H2O2将MnO2还原,同时本身被氧化产生O2,MnO2+H2O2+2H+![]() Mn2++2H2O.
Mn2++2H2O.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案