题目内容
(2009?长春一模)下图所涉及的物质均为中学化学中常见的物质,其中C、D为气体单质,E为常见金属单质,其余为化合物,F晶体具有磁性,它们之间存在如下转化关系(部分产物已省略).
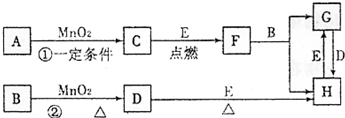
请回答下列问题:
(1)若反应①是在加热条件下进行的,则A是(填化学式)
(2)写出②的离子反应方程式:
(3)H用途广泛,如用作催化剂,印刷电路腐蚀剂和外伤止血济及净水等.若将Cu棒与碳棒用导线连接并插入H溶液中,可形成原电池,其中正极电极反应方程式为:
(4)写出G与D反应生成H的化学方程式为:

请回答下列问题:
(1)若反应①是在加热条件下进行的,则A是(填化学式)
KClO3
KClO3
;若反应①是在常温条件下进行的,则A是(填化学式)H2O2
H2O2
;若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为2:1
2:1
.(2)写出②的离子反应方程式:
MnO2+4H++2Cl-
Cl2+Mn2++2H2O
| ||
MnO2+4H++2Cl-
Cl2+Mn2++2H2O
.
| ||
(3)H用途广泛,如用作催化剂,印刷电路腐蚀剂和外伤止血济及净水等.若将Cu棒与碳棒用导线连接并插入H溶液中,可形成原电池,其中正极电极反应方程式为:
Fe3++e-=Fe2+
Fe3++e-=Fe2+
.(4)写出G与D反应生成H的化学方程式为:
2FeCl2+Cl2=2FeCl3
2FeCl2+Cl2=2FeCl3
.分析:根据F晶体具有磁性,为磁性氧化铁,即Fe3O4;E为Fe;因此C为O2.中学阶段与MnO2反应的制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用用MnO2作催化剂KClO3分解制备O2,用浓盐酸和MnO2制备Cl2,可推知A为KClO3或H2O2.B为HCl,C为O2,D为Cl2,则G为FeCl2,H为FeCl3,结合物质的性质解答该题.
解答:解:F晶体具有磁性,为磁性氧化铁,为Fe3O4,E为Fe;因此C为O2.中学阶段与MnO2反应的制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用MnO2作催化剂KClO3分解制备O2,用浓盐酸和MnO2制备Cl2,可推知A为KClO3或H2O2.B为HCl,C为O2,D为Cl2,则G为FeCl2,H为FeCl3,
(1)若反应①是在加热条件下进行的,用MnO2作催化剂KClO3分解制备O2,在不加热条件下,H2O2和MnO2制备O2,
H2O2起到催化剂的作用,根据化合价变化判断,已知:2KClO3
2KCl+3O2↑,
生成3mol转移12mol电子,2H2O2
2H2O+O2↑,生成3mol转移6mol电子,生成等物质的量的O2,反应中转移的电子数之比为2:1,
故答案为:KClO3;H2O2;2:1;
(2)MnO2和浓盐酸在加热条件下发生氧化还原反应生成氯气,反应的离子方程式为MnO2+4H++2Cl-
Cl2+Mn2++2H2O,
故答案为:MnO2+4H++2Cl-
Cl2+Mn2++2H2O;
(3)若将Cu棒与碳棒用导线连接并插入FeCl3溶液中,可形成原电池,负极为Cu,被氧化,正极发生还原反应,电极反应式为Fe3++e-=Fe2+,
故答案为:Fe3++e-=Fe2+;
(4)Cl2具有氧化性,FeCl2具有还原性,二者发生氧化还原生成FeCl3,反应的方程式为2FeCl2+Cl2=2FeCl3,
故答案为:2FeCl2+Cl2=2FeCl3.
(1)若反应①是在加热条件下进行的,用MnO2作催化剂KClO3分解制备O2,在不加热条件下,H2O2和MnO2制备O2,
H2O2起到催化剂的作用,根据化合价变化判断,已知:2KClO3
| ||
| △ |
生成3mol转移12mol电子,2H2O2
| ||
故答案为:KClO3;H2O2;2:1;
(2)MnO2和浓盐酸在加热条件下发生氧化还原反应生成氯气,反应的离子方程式为MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
(3)若将Cu棒与碳棒用导线连接并插入FeCl3溶液中,可形成原电池,负极为Cu,被氧化,正极发生还原反应,电极反应式为Fe3++e-=Fe2+,
故答案为:Fe3++e-=Fe2+;
(4)Cl2具有氧化性,FeCl2具有还原性,二者发生氧化还原生成FeCl3,反应的方程式为2FeCl2+Cl2=2FeCl3,
故答案为:2FeCl2+Cl2=2FeCl3.
点评:本题考查无机物的推断,题目难度不大,本题(1)为易错点,注意从化合价的变化角度分析.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
