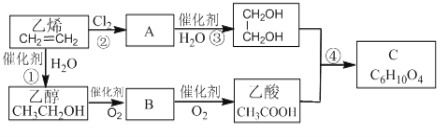
题目内容
【题目】现需配制0.1mol/LNaOH溶液450mL,这是某同学转移溶液的示意图。

(1)仪器c使用前必须____。
(2)①图中的错误是____。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:____。
②根据计算得知,需称出NaOH的质量为____g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,反复颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的___,溶液注入容量瓶前需恢复到室温,这是因为____;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作____;若加蒸馏水时不慎超过了刻度线___;若定容时俯视刻度线___;若配制完成后发现砝码和药品颠倒了(未使用游码),则结果____;若用天平称固体时,砝码上沾有油污,则所配制的溶液浓度将_____。
(5)若实验过程中加蒸馏水时不慎超过了刻度线应如何处理?____。
【答案】检查是否漏水 未用玻璃棒引流 药匙、胶头滴管、玻璃棒 2.0 B→C→A→F→E→D 将剩余的氢氧化钠全部转移到容量瓶中 溶液体积热胀冷缩,导致溶液浓度有偏差 偏低 偏低 偏高 无影响 偏高 重新配制溶液
【解析】
(1)仪器c是容量瓶,使用前必须检验是否漏水。
答案为:检查是否漏水;
(2)①配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅;配制溶液的操作步骤:首先计算出需要的药品的质量,然后用托盘天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2cm时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.用到的仪器有:天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故还需:玻璃棒、钥匙、胶头滴管,
故答案为:未用玻璃棒引流;玻璃棒、药匙、胶头滴管;
②由于无450mL容量瓶,故要选用500mL容量瓶,配制出500mL0.1mol/L的NaOH溶液,所需的NaOH的物质的量n=cV=0.5L×0.1mol/L=0.05mol,质量m=nM=0.05mol×40g/mol=2.0g,
故答案为:2.0;
③配制一定物质的量浓度溶液所需的步骤是:计算→称量→溶解→冷却→转移→洗涤→振荡→定容→摇匀→移液,
故答案为:B→C→A→F→E→D;
(3)把洗涤液转移到容量瓶中,目的是将剩余的氢氧化钠全部转移到容量瓶中,减少误差,NaOH遇水放出大量的热,因为热胀冷缩,恢复到室温状态下,溶液的体积会减小,所配溶液溶度会偏大,
故答案为:将剩余的氢氧化钠全部转移到容量瓶中;溶液体积热胀冷缩,导致溶液浓度有偏差;
(4)没有洗涤,容量瓶中溶质的物质的量减少,因此所配溶液的浓度偏低;加蒸馏水超过刻度线,相当于对原溶液进行稀释,因此所配溶液的浓度偏低;定容时俯视刻度线,溶液的体积低于刻度线,所配溶液的浓度偏高;若配制完成后发现砝码和药品颠倒了(未使用游码),则药品的质量等于砝码的质量,没有带来误差,则结果无影响;若用天平称固体时,砝码上沾有油污,称量的溶质质量偏大,则所配制的溶液浓度将偏高。
故答案为:偏低、偏低、偏高;无影响;偏高;
(5)加水超过刻度线,说明实验失败,重新配制,
故答案为:重新配制溶液。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案