题目内容
【题目】20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:

(1)图1中一定为饱和溶液的是_____。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为甲___乙。(大于、等于、小于)
(3)图3中表示乙的溶解度曲线是____(填曲线代码);P点表示的含义是_____。
(4)由图3知,30℃时,将20g甲固体溶于20g水,所得溶液的溶质质量分数为___。
【答案】甲 等于 N 30℃时,甲、乙两物质在水中的溶解度相等 37.5%
【解析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
①图1中,甲中还有未溶解的固体,所以甲一定为饱和溶液;
②20℃时将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,固体全部溶解,所以甲、乙两溶液中溶质质量分数为甲等于乙;
③根据20℃时乙的溶解度大于甲可知,图3中表示乙的溶解度曲线的是N;P点表示的含义是:30℃时,甲、乙物质的溶解度相等。
(4)由图3知,30℃时,甲的溶解度为60g,![]() ,将20g甲固体溶于20g水,形成饱和溶液,还有溶质末溶,所得溶液的溶质质量分数为60g/(60g+100g)×100%= 37.5%.
,将20g甲固体溶于20g水,形成饱和溶液,还有溶质末溶,所得溶液的溶质质量分数为60g/(60g+100g)×100%= 37.5%.

【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6. 4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是____________________;
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)= __________;
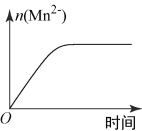
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
|
|
图1 | 图2 |
①该小组同学提出的假设是__________________________________________;
②请你帮助该小组同学完成实验方案,并填完表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | 向试管中加入少量固体 | ||
4 | 3.0 | 2.0 | 3.0 | 2.0 | _____________ | t |
③若该小组同学提出的假设成立,应观察到的现象是______________________。