题目内容
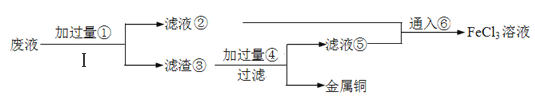
【题目】钪(Sc)及其化合物在电子、宇航、超导等方面有着广泛的应用。某工厂的钛白水解工业废酸中,Sc3+浓度为18mg/L,还含有大量的TiO2+、Fe3+、H+、SO42-等。下图为从该工业废酸中提取Sc2O3的一种流程。

回答下列问题:
(1)在钛白水解工业废酸中,加入双氧水是为了使TiO2+转化为难萃取的[Ti(O2)(OH(H2O)4]+。[Ti(O2)(OH(H2O)4]+中Ti的化合价为+4,其中非极性键的数目为_______。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如左下图,应选择的最佳O/A值为_______;温度对钪、钛的萃取率影响情况见右下表,合适的萃取温度为10-15℃,其理由是_____________________。

(3)洗涤“油相“可除去大量的钛离子。洗染水是用浓硫酸、双氧水和水按一定比例混合而成。混合过程的实验操作为________________。
(4)25℃时,用氨水调节滤液的pH,当pH=3.5时,滤渣II的主要成分是_______;当pH=6时,滤液中Sc3+的浓度为________。(Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(5)写出用草酸(H2C2O4)“沉钪”得到Sc2(C2O4)3的离子方程式_____________。
(6)若从1m3该工厂的钛白水解度酸中提取得到24.4gSc2O3,则钪的提取率为______(保留三位有效数字)。
【答案】 1 1:4(或1:5或1:4~1:5) 低于10℃时,钪的萃取率不够高;高于15℃时,钛的萃取率增大较多 将浓硫酸沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌,冷却后再慢慢注入H2O2,并不断搅拌 Fe(OH)3 9.0×10-7mol/L 2Sc3++3H2C2O4=Sc(C2O4)3↓+6H+ 0.884(或88.4%)
【解析】(1) [Ti(O2)(OH(H2O)4]+中Ti的化合价为+4,OH-、H2O均只含极性键,O22-含有1个非极性键,故[Ti(O2)(OH(H2O)4]+中非极性键的数目为1;(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如左下图,应选择的最佳O/A值为1:4(或1:5或1:4~1:5);温度对钪、钛的萃取率影响情况见右下表,合适的萃取温度为10-15℃,其理由是低于10℃时,钪的萃取率不够高;高于15℃时,钛的萃取率增大较多;(3)洗涤“油相“可除去大量的钛离子。洗染水是用浓硫酸、双氧水和水按一定比例混合而成。混合过程的实验操作为将浓硫酸沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌,冷却后再慢慢注入H2O2,并不断搅拌;(4)当pH=3.5时,由于Ksp[Fe(OH)3]<Ksp[Sc(OH)3],Fe(OH)3先转化为沉淀,故滤渣II的主要成分是Fe(OH)3;当pH=6时,c(OH-)=10-8mol/L,Ksp[Sc(OH)3]= c(Sc3+)c3(OH-)= c(Sc3+)× (10-8mol/L)3=9.0×10-31,滤液中Sc3+的浓度为9.0×10-7mol/L;(5)用草酸(H2C2O4)“沉钪”得到Sc2(C2O4)3,反应的离子方程式2Sc3++3H2C2O4=Sc(C2O4)3↓+6H+;(6)Sc3+浓度为18mg/L,若从1m3该工厂的钛白水解度酸中提取得到24.4gSc2O3,则钪的提取率为![]() 。
。

【题目】I. “铝热反应”的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是____________________________________________________________。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,当观察到________时,说明熔融物中含有金属铝。
(3)实验室溶解该熔融物,最好选用下列试剂中的____(填字母)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II. 已知固体Na2SO3受热易分解。实验流程和结果如下:
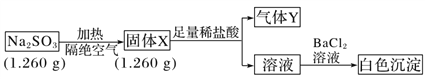
气体Y是一种纯净物,在标准状况下的密度为1.518 g·L-1,请回答:
(4)气体Y分子的电子式______________,白色沉淀的化学式______________。
(5)该流程中Na2SO3受热分解的化学方程式____________________________________。
(6)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式__________________________ (不考虑空气的影响)。
【题目】在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g)![]() 2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol/L)的变化结果如下:
2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol/L)的变化结果如下:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是
A. 实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol/( L·min)
B. 实验①、②条件下的平衡常数相等,且小于实验③条件下的平衡常数
C. 2号Cu2O的催化效率比1号Cu2O的催化效率高
D. 实验时的温度T2高于T1