题目内容
【题目】I. “铝热反应”的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是____________________________________________________________。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,当观察到________时,说明熔融物中含有金属铝。
(3)实验室溶解该熔融物,最好选用下列试剂中的____(填字母)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II. 已知固体Na2SO3受热易分解。实验流程和结果如下:
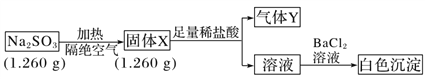
气体Y是一种纯净物,在标准状况下的密度为1.518 g·L-1,请回答:
(4)气体Y分子的电子式______________,白色沉淀的化学式______________。
(5)该流程中Na2SO3受热分解的化学方程式____________________________________。
(6)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式__________________________ (不考虑空气的影响)。
【答案】 该反应温度下铝已熔化,未反应的铝与生成的铁熔合在一起 NaOH溶液 有气泡生成 B ![]() BaSO4 4Na2SO3
BaSO4 4Na2SO3![]() Na2S+3Na2SO4 2S2-+SO
Na2S+3Na2SO4 2S2-+SO![]() +6H+===3S↓+3H2O
+6H+===3S↓+3H2O
【解析】分析:I.(1)当金属铁是液态时,由于金属铝的熔点比铁低,所以金属铝也是液态;
(2)金属铝能和氢氧化钠反应放出氢气而金属铁和氢氧化钠不反应;
(3)既能和金属铁反应又能和金属铝反应的物质是稀硫酸,并且获得的产物无污染。
Ⅱ.固体Na2SO3在隔绝空气的条件下分解,固体的质量不变,说明没有生成气体,加入盐酸生成气体,且溶液加入氯化钡生成白色沉淀,可知固体X为Na2S和Na2SO4混合物,Y为H2S,结合问题解答该题。
详解:I.(1)根据表中的数据可以看出,金属铝的熔点比铁低,当金属铁是液态时,金属铝也是液态,未反应的铝与生成的铁熔合在一起,所以铝热反应得到的是金属铁和金属铝的混合物;
(2)金属铝能和氢氧化钠反应放出氢气而金属铁和氢氧化钠不反应,反应方程式是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,因此可以用氢氧化钠溶液证明上述所得的块状熔融物中含有金属铝;
(3)既能和金属铁反应又能和金属铝反应的物质是稀硫酸,并且获得的产物无污染,浓硫酸在常温下可以和金属铝钝化,稀硝酸可以和金属反应产生有毒的一氧化氮气体,氢氧化钠只和金属铝反应而和金属铁不反应,因此答案选B。
Ⅱ.(4)气体Y是一种纯净物,在标准状况下的密度为1.518 g·L-1,因此相对分子质量是1.518×22.4=34,Y为H2S,属于共价化合物,电子式为![]() ,白色沉淀为硫酸钡,化学式为BaSO4;
,白色沉淀为硫酸钡,化学式为BaSO4;
(5)由以上分析可知Na2SO3受热分解生成Na2S和Na2SO4,根据质量守恒定律可知反应的化学方程式为4Na2SO3![]() Na2S+3Na2SO4;
Na2S+3Na2SO4;
(6)固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,沉淀是单质硫,这是由于在酸性溶液中亚硫酸根离子能氧化硫离子,反应的离子方程式为2S2-+SO32-+6H+=3S↓+3H2O。

 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
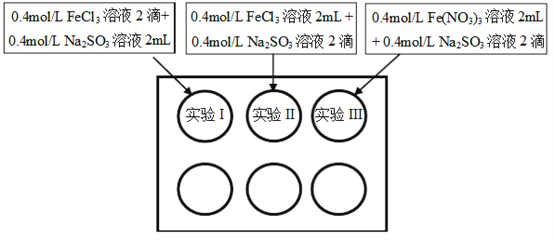
小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-