题目内容
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | k2 |
iii. C(s)+CO2(g) | +172 | k3 |
试计算,X=____,K1、K2与K3之间的关系为__________________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_______(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持温度体积不变,增大CO浓度
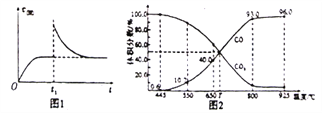
(3)在一定温度下,向某体积可变的恒压密闭容器(P总)加入1molCO2与足最的碳,发生反应iii,平衡时体系中气体体积分数与温度的关系如图2所示。
①650℃时,该反应达平衡后吸收的热量是__________。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按v(CO2):V(CO)=5:4的混合气体,平衡______(填“正向”、”逆向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压化替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示(导电壳内部为纳米零价铁)。
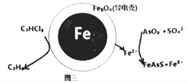
在除污过程中,纳米零价铁中的Fe为原电池的____极(填“正”或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为____________________。
(5)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。
②Ksp(HgS)=_______________。
【答案】 -27 K3=(K1/K2)1/3 ad 43kJ 正向 23.04p总 负 C2HCl3 +5H++8e-=C2H6 +3Cl- ![]() 4.0×10-53
4.0×10-53
【解析】(1) 已知i. Fe2O3(s)+3C(s)![]() 2Fe(s)+3CO(g) △H=+489 kJ/mol,
2Fe(s)+3CO(g) △H=+489 kJ/mol,
iii. C(s)+CO2(g)![]() 2CO(g) △H=+172 kJ/mol,
2CO(g) △H=+172 kJ/mol,
根据盖斯定律可知,i- iii![]() 3得Fe2O3(s)+3CO(g)
3得Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=-27 kJ/mol
2Fe(s)+3CO2(g) △H=-27 kJ/mol
由上述过程可知:![]() =K2,即K3=(K1/K2)1/3 ,因此,本题正确答案为:-27 ;K3=(K1/K2)1/3
=K2,即K3=(K1/K2)1/3 ,因此,本题正确答案为:-27 ;K3=(K1/K2)1/3
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)突然增大,但重新达到平衡状态后与原平衡相同,说明温度不变,平衡常数K=c3(CO)不变,则t1时刻改变的条件压缩容器的体积或增大CO的浓度,故答案为:ad。
(3) ①由图2可知,650℃时,该反应达平衡后,CO的体积分数为40%,根据化学平衡“三行式”有: C(s)+CO2(g)![]() 2CO(g)
2CO(g)
起始(mol) 1 0
转化(mol) x 2x
平衡(mol) 1-x 2x
则![]() 100%=40%,解得:x=0.25mol。
100%=40%,解得:x=0.25mol。
由反应:C(s)+CO2(g)![]() 2CO(g) △H=+172 kJ/mol可知该反应达平衡后吸收的热量是:
2CO(g) △H=+172 kJ/mol可知该反应达平衡后吸收的热量是:
0.25mol![]() 172kJ/mol=43 kJ,故答案为43kJ
172kJ/mol=43 kJ,故答案为43kJ
②T℃时,若向平衡体系中再充入一定量按v(CO2):V(CO)=5:4的混合气体,因原平衡时v(CO2):V(CO)=1:1,由于5:4>1:1,故平衡正向移动,因此答案为:正向。
③925℃时,CO的体积分数为96%,则CO2的体积分数为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=![]() =23.04p总,故答案为23.04p总。
=23.04p总,故答案为23.04p总。
(4)由如图3可知纳米零价铁中的Fe失去电子作负极,C2HCl3在其表面被还原为乙烷,根据电荷守恒和原子守恒,该电极反应式为C2HCl3 +5H++8e-=C2H6 +3Cl-。故答案为:负 ;C2HCl3 +5H++8e-=C2H6 +3Cl-。
(5)①NaHS为含有共价键的离子化合物,其电子式为:![]()
②由已知:I.Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq) K=1.75×1038,
HgS(s)+H+(aq) K=1.75×1038,
II.HS-![]() H++S2- Ka2=7.0×10-15,
H++S2- Ka2=7.0×10-15,
II-I得:HgS(s)![]() =4.0×10-53,因此,本题答案为:
=4.0×10-53,因此,本题答案为:![]() ;4.0×10-53。
;4.0×10-53。

【题目】下列有关实验操作的解释或结论正确的是
选项 | 实验操作 | 解释或结论 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 用蒸馏水润湿的pH试纸测溶液pH | 一定会使测定结果偏低 |
C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
D | 用氢氧化钾与浓硫酸测定中和反应的反应热 | 测得的结果偏小 |
A. A B. B C. C D. D
【题目】氮及其化合物在工农业生产、生活中有着重要应用。
(1)氯胺[NH2Cl(g)]是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,试写出其杀菌过程中与水反应的化学方程式________________。
(2)羟胺(NH2OH)是有机合成的常见还原剂。工业上可用硝酸.硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为________________。
(3)银氨溶液是检验醛基的重要试剂,其溶液中存在Ag(NH3)2+(aq)![]() Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)
Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=________________。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=________________。
(4)水合肼(N2H4·H2O)常用作锅炉水的除氧剂。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O![]() N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为________________,溶液中离子浓度由大到小的排列顺序为________________。
N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为________________,溶液中离子浓度由大到小的排列顺序为________________。
(5)氨是一种重要的氮肥。工业合成氨反应为:![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g),该反应的活化能Ea1=254kJ/mol。
NH3(g),该反应的活化能Ea1=254kJ/mol。
①查阅文献,相关化学键键能数据如下:
化学键 | H-H | N | N-H |
E/kJ·mol-1 | 436 | 946 | 391 |
则反应NH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)的活化能Ea2=________________。
H2(g)的活化能Ea2=________________。
②一定条件下,1molN2与3.6molH2在密闭容器中充分反应,测得放出的热量为13.8kJ,则H2的转化率为________________,为提高原料的利用率,工业合成氨应该采取的措施是=________________。




