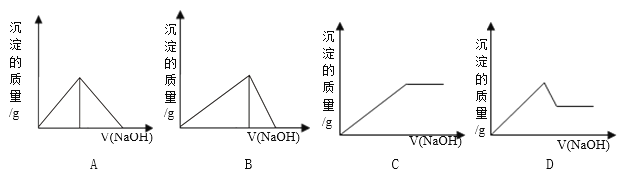
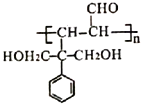
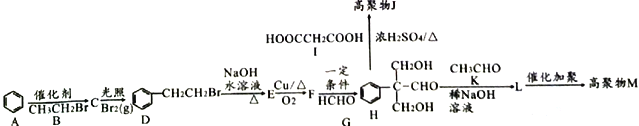
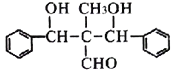题目内容
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 28g乙烯和丙烯中的极性键数目为4NA
B. 32gCu和32gS充分反应,转移电子数为NA
C. 1L0.3mol·L-1Na2CO3溶液中的阴离子数目小于0.3NA
D. 0.2molNH3与0.3molO2在催化剂的作用下充分反应,所得NO的分子数为0.2NA
【答案】A
【解析】A.乙烯和丙烯的最简式为CH2,28gCH2的物质的量为2mol,而2molCH2中含4mol极性键,所以28g乙烯和丙烯中的极性键数目为4NA,A正确;B. Cu和S反应生成Cu2S,Cu不足,转移电子数为0.5NA,B错误;C.CO32-水解生成HCO3-和OH-,导致阴离子数目增多,因此1L0.3mol·L-1Na2CO3溶液中的阴离子数目大于0.3NA,C错误;D.依据4NH3+5O2![]() 4NO+6H2O,0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,氧气剩余,则生成的一氧化氮部分与氧气反应生成二氧化氮,所以最终生成一氧化氮分子数小于0.2NA,D错误;答案选A.
4NO+6H2O,0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,氧气剩余,则生成的一氧化氮部分与氧气反应生成二氧化氮,所以最终生成一氧化氮分子数小于0.2NA,D错误;答案选A.

 53随堂测系列答案
53随堂测系列答案【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | k2 |
iii. C(s)+CO2(g) | +172 | k3 |
试计算,X=____,K1、K2与K3之间的关系为__________________。
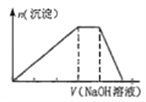
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_______(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持温度体积不变,增大CO浓度
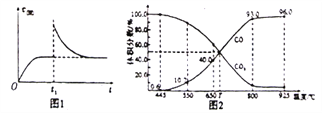
(3)在一定温度下,向某体积可变的恒压密闭容器(P总)加入1molCO2与足最的碳,发生反应iii,平衡时体系中气体体积分数与温度的关系如图2所示。
①650℃时,该反应达平衡后吸收的热量是__________。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按v(CO2):V(CO)=5:4的混合气体,平衡______(填“正向”、”逆向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压化替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示(导电壳内部为纳米零价铁)。
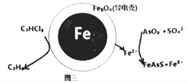
在除污过程中,纳米零价铁中的Fe为原电池的____极(填“正”或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为____________________。
(5)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。
②Ksp(HgS)=_______________。