题目内容
【题目】某研究性学习小组将甲、乙、丙装置连接如图,除G、H外所有电极均为惰性电极。电解一段时间后,D电极质量增加。试回答下列问题:
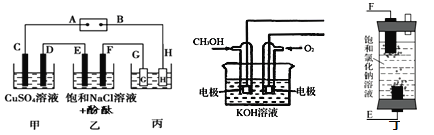
(1)电源A极是____极(填“正”或“负”);乙装置F电极附近的现象是____。
(2)欲用丙装置给铜镀银。G应该是____(填“Ag”或“Cu”)。
(3)如用甲醇燃料电池(如图)充当电源,写出负极的电极反应方程式:____;若用丁装置(如图)代替乙装置,写出丁装置中反应的总化学方程式是____。
【答案】(1)正;溶液变红;(2)Ag;(3)CH3OH-6e-+8OH-=CO32-+6H2O;NaCl+H2O![]() NaClO+H2↑。
NaClO+H2↑。
【解析】
试题分析:(1)D电极质量增加,此电极反应式为Cu2++2e-=Cu,根据电解原理,阳离子在阴极上得电子,因此C为阳极,D为阴极,阳极跟电源的正极相连,A为正极,B为负极,此电路是串联电路,E为阳极,F为阴极,F电极反应式为2H2O+2e-=H2↑+2OH-,酚酞遇碱变红;(2)G为阳极,H为阴极,电镀中待镀金属作阴极,镀层金属作阳极,因此是G为银;(3)充燃料的一极为负极,电解质为NaOH溶液,因此电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O;E电极反应式Cl-2e-=Cl2↑,F电极反应式为2H2O+2e-=H2↑+2OH-,Cl2+2OH-=Cl-+ClO-+H2O,因此总反应方程式为:NaCl+H2O![]() NaClO+H2↑。
NaClO+H2↑。

练习册系列答案
相关题目