题目内容
【题目】(12分)NaCN为剧毒无机物。某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
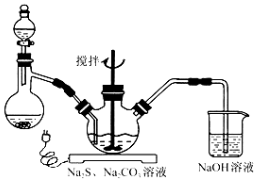
实验Ⅰ.硫代硫酸钠晶体(Na2S2O35H2O)的制备
已知Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水。现以亚硫酸钠、硫化钠和碳酸钠等为原料、采用下述装置制备硫代硫酸钠,反应原理为:
①Na2CO3+SO2=Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+S![]() Na2S2O3
Na2S2O3
(1)将硫化钠和碳酸钠按反应要求的比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在蒸馏烧瓶中加入亚硫酸钠固体,在分液漏斗中注入_____________(填以下选择项的字母),并按上图安装好装置,进行反应。
A.稀盐酸 B.浓盐酸 C.70%的硫酸 D.稀硝酸
从以上反应可知Na2S 与Na2CO3的最佳物质的量比是___________________。
(2)pH小于7即会引起Na2S2O3溶液的变质反应,会出现淡黄色混浊。反应约半小时,当溶液中pH接近或不小于7时,即可停止通气和加热。如果SO2通过量,发生的化学反应方程式为____________________.
(3)从上述生成物混合液中获得较高产率Na2S2O35H2O的歩骤为
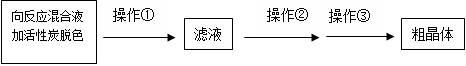
为减少产品的损失,操作①为趁热过滤, 操作②是________;操作③是抽滤、洗涤、干燥。
Ⅱ.产品纯度的检测
已知:Na2S2O35H2O的摩尔质量为248g/mol;2Na2S2O3+I2=2NaI+Na2S4O6。取晶体样品ag,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液vmL,则该样品纯度是______________
Ⅲ.有毒废水的处理化学兴趣小组的同学在配备防毒口罩,橡胶手套和连衣式胶布防毒衣等防护用具以及老师的指导下进行以下实验:
向装有2ml0.1mol/L 的NaCN溶液的试管中滴加2ml0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但没有明显实验现象,取反应后的溶液少许滴入盛有10ml0.1mol/L FeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式_________________。
【答案】
Ⅰ. (1)C;2:1;
(2)Na2S2O3 +SO2+H2O=2NaHSO3+S↓;
(3)蒸发浓缩,冷却结晶;
Ⅱ、![]() %;
%;
Ⅲ. CN-+S2O32-=SCN-+SO32-。
【解析】
试题分析:Ⅰ. (1)根据反应装置可知,左边烧瓶是生成二氧化硫的装置,浓硫酸与亚硫酸钠固体反应可以生成二氧化硫,将①+②×2+3+③×3得:Na2CO3 +2Na2S+4SO2+2H2O= CO2+3Na2S2O3+2H2O,因此Na2S 与Na2CO3的最佳物质的量比为2:1,故答案为:C;2:1;
(2)pH小于7即会引起Na2S2O3溶液的变质反应,会出现淡黄色混浊。因此SO2通过量,发生的化学反应方程式为Na2S2O3 +SO2+H2O=2NaHSO3+S↓,故答案为:Na2S2O3 +SO2+H2O=2NaHSO3+S↓;
(3)从滤液中提取溶质的一般方法是蒸发浓缩,冷却结晶,故答案为:蒸发浓缩,冷却结晶;
Ⅱ、vmL0.010mol/L碘水溶液中n(I2)=v×10-3L×0.010mol/L=v×10-5mol,则:
2Na2S2O3~~~~~~~I2
2 1
n(Na2S2O3) v×10-5mol
所以n(Na2S2O3)=2×v×10-5mol=2v×10-5mol,Na2S2O35H2O晶体的质量为2v×10-5mol×248g/mol =496v×10-5g,则该样品纯度为![]() ×100%=
×100%=![]() %,故答案为:
%,故答案为:![]() %;
%;
Ⅲ. 等物质的量的NaCN和Na2S2O3恰好完全反应,但没有明显实验现象,取反应后的溶液少许滴入盛有10ml0.1mol/L FeCl3溶液的小烧杯,溶液呈现血红色,说明生成了SCN-,在SCN-中S为-2价,N为-3价,C为+4价,S由+2价变成-2价,化合价降低4,,反应中C元素化合价由+2价变为+4价,化合价升高2,则S化合价需升高2,即由+2价变成+4价,因此生成SO32-,Na2S2O3解毒的离子反应方程式CN-+S2O32-=SCN-+SO32-,故答案为:CN-+S2O32-=SCN-+SO32-。

 53随堂测系列答案
53随堂测系列答案