题目内容
【题目】(10分)利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如下图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用。
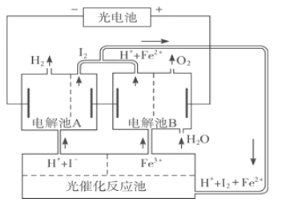
(1)写出电解池A、电解池B和光催化反应池中反应的离子方程式。
(2)若电解池A中生成3.36 L H2(标准状况),电解池B中生成Fe2+的物质的量为 。
(3)若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
【答案】
(1)电解池A:2H++2I-![]() H2↑+I2
H2↑+I2
电解池B:4Fe3++2H2O ![]() O2↑+4H++4Fe2+
O2↑+4H++4Fe2+
光催化反应池:2Fe2++I2![]() 2Fe3++2I-
2Fe3++2I-
(2)0.3 mol;
(3) c/(a-b)L·min-1
【解析】
试题分析:(1)由图可知,电解池A中,电解HI生成氢气与I2,电解池中总反应的离子方程式为:2H++2I-![]() H2↑+I2 ,电解池B中为电解铁盐溶液,生成Fe2+、O2、H+,电解池中总反应的离子方程式为:4Fe3++2H2O
H2↑+I2 ,电解池B中为电解铁盐溶液,生成Fe2+、O2、H+,电解池中总反应的离子方程式为:4Fe3++2H2O![]() 4Fe2++O2↑+4H+,光催化反应池中为Fe2+、I2、H+,生成Fe3+、I-、H+,光催化反应池中总反应的离子方程式为:2Fe2++I2
4Fe2++O2↑+4H+,光催化反应池中为Fe2+、I2、H+,生成Fe3+、I-、H+,光催化反应池中总反应的离子方程式为:2Fe2++I2![]() 2Fe3++2I-,故答案为:2H++2I-
2Fe3++2I-,故答案为:2H++2I-![]() H2↑+I2 ;4Fe3++2H2O
H2↑+I2 ;4Fe3++2H2O![]() 4Fe2++O2↑+4H+;2Fe2++I2
4Fe2++O2↑+4H+;2Fe2++I2![]() 2Fe3++2I-;
2Fe3++2I-;
(2)若电解池A中生成3.36LH2(标准状况),氢气的物质的量=![]() =0.15mol,转移电子物质的量=0.15mol×2=0.3mol,根据电子转移守恒,电解池B中生成Fe2+的物质的量为
=0.15mol,转移电子物质的量=0.15mol×2=0.3mol,根据电子转移守恒,电解池B中生成Fe2+的物质的量为![]() =0.3mol,故答案为:0.3mol;
=0.3mol,故答案为:0.3mol;
(3)若电解池A中流入和流出的HI浓度分别为amol/L和bmol/L,则单位时间内消耗的HI的物质的量为(a-b)×Qmol/L,根据反应方程式得失电子守恒,光催化反应池中单位时间内生成Fe3+的物质的量为cmol/min,则有(a-b)×Qmol/L=cmol/min,故答案为:Q=![]() L/min
L/min