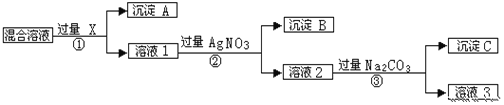
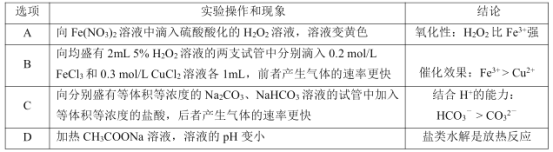
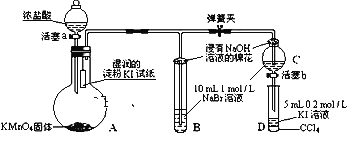
题目内容
【题目】焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
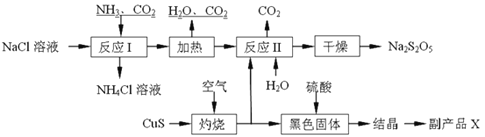
已知:反应Ⅱ包含2NaHSO3![]() Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:____________________________________________。
(2)“灼烧”时发生反应的化学方程式:__________________________________________。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:________________________。
(4)副产品X的化学式是:____________;可循环利用的物质是:__________________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为_______。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑ 2CuS+3O2
CaCl2+2H2O+2NH3↑ 2CuS+3O2 ![]() 2CuO+2SO2 S2O52-+2H+=2SO2↑+H2O CuSO4·5H2O CO2、H2O 2∶1
2CuO+2SO2 S2O52-+2H+=2SO2↑+H2O CuSO4·5H2O CO2、H2O 2∶1
【解析】
(1)实验室利用氯化铵与碱石灰共热制备氨气,该反应为Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(2)硫化铜在空气中灼烧生成氧化铜、SO2,反应的化学方程式为2CuS+3O2![]() 2CuO+2SO2;
2CuO+2SO2;
(3)Na2S2O5与稀硫酸反应放出SO2,则根据原子守恒可知还有水生成,因此其离子方程式为S2O52-+2H+=2SO2↑+H2O。
(4)氧化铜与稀硫酸反应生成硫酸铜和水,因此结晶后得到的X是硫酸铜晶体。反应I中需要CO2,而在反应Ⅱ中生成CO2,但需要水处于。在加热过程中有CO2和水生成,所以可以循环利用的物质是CO2和水。
(5)反应Ⅱ发生Na2CO3+2SO2+H2O=2NaHSO3+CO2,则为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为2:1。