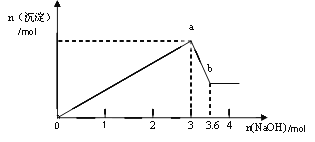
题目内容
【题目】有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离。相应的实验过程可用如图表示:
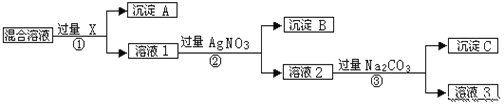
请回答下列问题:
①沉淀A的化学式:________
②过程③中加入过量的Na2CO3的目的是_______________
③按此实验方案得到的溶液3中比原溶液多了___________离子(填化学式),除去该离子的方法是_________
④为了尽可能完全分离三种离子,步骤①②③过滤后都需要洗涤,请描述洗涤操作_____________
【答案】BaSO4 除去过量的Ba(NO3)2和AgNO3 CO32- 加入稍过量的稀硝酸 往漏斗内加水浸没沉淀,待水自然流出后,重复以上操作2~3次
【解析】
①沉淀Cl-时,通常需加入Ag+,沉淀SO42-时,通常需加入Ba2+,若先加入Ag+,Cl-、SO42-都会转化为沉淀,所以应先加入Ba2+,让SO42-生成沉淀。
②因为沉淀Cl-、SO42-时,加入的除杂试剂都是过量的,过量的除杂试剂又成为杂质,需要再除去,所以过程③中加入过量的Na2CO3。
③加入了过量的Na2CO3,溶液中必然存在CO32-,要除去它,选择试剂时,需考虑不能引入杂质离子。
④因为沉淀都难溶于水,所以可用水洗涤。
①经过以上分析,确定先加入Ba(NO3)2,从而得出沉淀A的化学式BaSO4。答案为:BaSO4;
②因为除去Cl-、SO42-时,加入的除杂试剂都是过量的,所以过程③中加入过量的Na2CO3的目的是除去过量的Ba(NO3)2和AgNO3。答案为:除去过量的Ba(NO3)2和AgNO3;
③加入了过量的Na2CO3,溶液中必然存在CO32-,所以得到的溶液3中比原溶液多了CO32-,除去该离子的方法是加入稍过量的稀硝酸。答案为:CO32-;加入稍过量的稀硝酸;
④洗涤操作为:往漏斗内加水浸没沉淀,待水自然流出后,重复以上操作2~3次。答案为:往漏斗内加水浸没沉淀,待水自然流出后,重复以上操作2~3次。

【题目】金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂。20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键。
步骤:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH=+1493kJmol-1,ΔS=+61JK-1mol-1
该反应发生温度高达2170℃,能耗大,对设备和生产要求几乎达到苛刻程度。目前科学家采用金红石加碳氯化方法,在较温和条件下成功制取TiCl4,为人类快速迈进钛合金时代做出了巨大贡献。金红石加碳氯化的主要反应如下:
反应Ⅰ:TiO2(s)+2Cl2(g) +C(s)![]() TiCl4(g)+CO2(g) ΔH1,ΔS1=+64JK-1mol-1
TiCl4(g)+CO2(g) ΔH1,ΔS1=+64JK-1mol-1
反应Ⅱ:TiO2(s)+2Cl2(g) +2C(s)![]() TiCl4(g)+2CO(g) ΔH2,△S2
TiCl4(g)+2CO(g) ΔH2,△S2
已知:①C(s)+O2(g)=CO2(g) ΔH=-394.3kJmol-1
②2C(s)+O2(g)=2CO(g) ΔH=-222.3kJmol-1
请回答:
(1)反应Ⅰ的ΔH1=__kJmol-1。
(2)对于气体参加的反应,表示平衡常数KP时,用气体组分B的平衡压强P(B)代替该气体物质的量浓度c(B),则反应Ⅰ的KP=__(用表达式表示)。
(3)在常温、常压、光照条件下,N2在催化剂TiO2表面与H2O发生反应,2N2(g)+6H2O(1)=4NH3(g)+3O2(g) ΔH=+1530.4kJmol-1
进一步研究相同条件下NH3生成量与温度的关系,部分实验数据见表:
实验组别 | 1 | 2 | 3 | 4 |
T/K | 303 | 313 | 323 | 353 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
O2生成量/(10-6mol) | 3.6 | 4.4 | 4.5 | 1.5 |
反应时间/h | 3 | 3 | 3 | 3 |
容器体积/L | 2 | 2 | 2 | 2 |
①请在如图中画出上述反应在“有催化剂”与“无催化剂”两种情况下反应过程中体系能量随反应过程的变化趋势示意图(图中标明必要的文字说明)。___
②根据表中数据,在303K时,在3h内用氮气表示其平均反应速率为___molL-1h-1。判断组别4中反应是否达到平衡状态___(填“是”或“否”),并说明理由___。