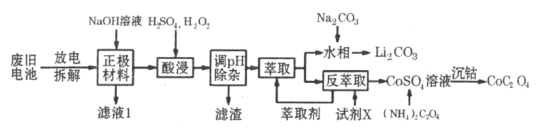
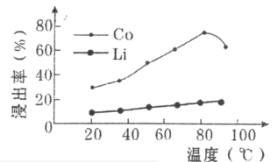
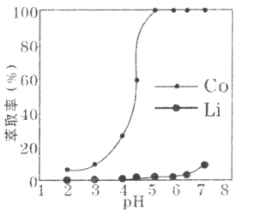
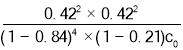题目内容
【题目】为验证氯、溴、碘三种元素的非金属性强弱,用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。
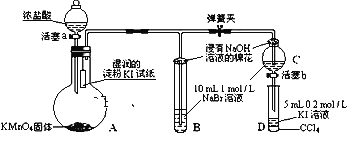
实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液由黄色变为棕红色时,关闭活塞a。
④……
(1)A中发生反应生成氯气,该反应的离子方程式为_____________。
(2)验证氯气的氧化性强于碘的实验现象是__________________。
(3)B、C管口“浸有NaOH溶液的棉花”的作用是______________。
(4)为验证溴的氧化性强于碘,过程④的操作和现象是____________。
(5)过程③实验的目的是____________。
(6)运用原子结构理论解释氯、溴、碘非金属性逐渐减弱的原因是_______________。
【答案】2MnO4-+16H++10Cl-= 2Mn2++5Cl2↑+8H2O 淀粉KI试纸变蓝 吸收氯气,防止污染 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色 确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰 同主族元素从上到下,原子半径逐渐增大,得电子能力逐渐减弱
【解析】
(1)A中发生反应生成Cl2,是高锰酸钾溶液氧化浓盐酸生成的;
(2)氯气遇湿润的淀粉-KI试纸变蓝色;
(3)B、C管口“浸有NaOH溶液的棉花”是吸收氯气防止污染;
(4)溴单质氧化性大于碘单质,溴单质将I-氧化为I2,应将C中生成的溴加入到盛有KI溶液的D中,观察CCl4中颜色变化;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为红棕色时,说明有大量的溴生成;
(6)同主族元素,从上到下,电子层数越多,原子半径越大,金属元素的金属性越强。
(1)A中高锰酸钾溶液将浓盐酸氧化生成Cl2,反应方程式为:2KMnO4+16HCl=5Cl2↑+2MnCl2+2KCl+8H2O,离子方程式为:2MnO4-+16H++10Cl-= 2Mn2++5Cl2↑+8H2O;
(2)淀粉变蓝色,说明生成了I2,说明氯气的氧化性强于碘的氧化性;
(3)B、C管口“浸有NaOH溶液的棉花”的作用是:吸收氯气,防止污染;
(4)为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静置后CCl4层变为紫红色,因此过程④的操作和现象是打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。静止后CCl4层溶液变为紫红色;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为红棕色时,说明有大量的溴生成,此时关闭活塞a,否则Cl2过量,影响实验结论;
(6)同主族元素,从上到下,电子层数越多,原子半径越大,金属元素的金属性越强,得电子能力逐渐减弱。

 阅读快车系列答案
阅读快车系列答案【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
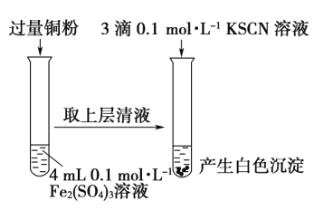
实验Ⅰ:将![]() 转化为
转化为![]()
查阅资料:
已知:①![]() 的化学性质与
的化学性质与![]() 相似
相似
②![]()
实验Ⅱ:将![]() 转化为
转化为![]()
实验方案 | 现象 |
向 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:![]() (棕色)
(棕色)
下列说法不正确的是
A.取![]() 溶液,向其中滴加3滴
溶液,向其中滴加3滴![]() 溶液,产生白色沉淀
溶液,产生白色沉淀
B.取![]() 溶液,向其中滴加3滴
溶液,向其中滴加3滴![]() 溶液,产生白色沉淀
溶液,产生白色沉淀
C.![]() 与
与![]() 反应的离子方程式为
反应的离子方程式为![]()
D.产生![]() 的原因:
的原因:![]()