题目内容
【题目】(1)已知:① CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g)![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
则CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH=_________________。
CH4(g)+2H2O(g) ΔH=_________________。
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:
CO(g)+3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图所示。

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由______________________________。
②M点的平衡常数Kp=_____________________。(只列算式。Kp的表达式是将平衡分压代替平衡浓度。某物质的平衡分压=总压×该物质的物质的量分数)
(3)下图表示在一定条件下的1 L的密闭容器中, X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况。下表是3 mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%)。


①X、Y、C三种气体发生反应的化学方程式为_________________________。
②表中a的取值范围是________________________________。
③根据上图和上表分析,25 min~40 min内图中曲线发生变化的原因可能是________。
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.己知:25℃时,几种酸的电离平衡常数如下表所示。
H2CO3 | H2SO3 | HNO2 | HClO |
K1=4.4×10-7 K2=4.7×10-11 | K1=1.2×10-2 K2=6.6×10-8 | K=7.2×10-4 | K=2.9×10-8 |

25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:
①NaHSO3、②HNO2、③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如上图所示。其中符合曲线Ⅱ的溶液为__________。
【答案】 -162 kJ·mol-1 与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低 Kp =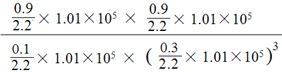 pa-2 Y+3X
pa-2 Y+3X![]() 2C 25.1<a<64.2 缩小容器体积或增大压强 ①③
2C 25.1<a<64.2 缩小容器体积或增大压强 ①③
【解析】(1)①CO(g)+H2O(g)H2(g)+CO2(g)△H=-41kJmol-1
②C(s)+2H2(g)CH4(g)△H=-73kJmol-1
③2CO(g)C(s)+CO2(g)△H=-171kJmol-1
盖斯定律计算②+③-①×2 得到CO2(g)+4H2(g)═CH4(g)+2H2O(g)△H=-162kJmol-1;
(2)①依据盖斯定律计算:①CO(g)+H2O(g)H2(g)+CO2(g)△H=-41kJmol-1;②C(s)+2H2(g)CH4(g)△H=-73kJmol-1;③2CO(g)C(s)+CO2(g)△H=-171kJmol-1;②+③-①得到CO(g)+3H2(g)CH4(g)+H2O(g),△H=-203KJ/mol;反应是气态体积减小的放热反应,低温高压促进平衡正向进行,图象分析可知,与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低;
②M点氢气转化率为90%,CO和H2按物质的量比1:3,设为1mol、3mol,结合化学反应三行计算得到平衡物质的量,计算物质的平衡分压=总压×该物质的物质的量分数,得到平衡常数,压强为1.01×105,
CO(g)+3H2(g)CH4(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.9 2.7 0.9 0.9
平衡量(mol) 0.1 0.3 0.9 0.9
总物质的量=2.2mol,
M点的平衡常数Kp=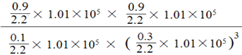 ;
;
(3)①图象分析可知XY为反应物,C为生成物,X物质的量消耗3mol-9×0.25mol=0.75mol,Y消耗物质的量=0.25mol,C生成物质的量为0.5mol,物质的量之比等于化学方程式计量数之比,据此写出化学方程式:Y+3X2C;
②Y+3X2C,反应是气体体积减小的反应,压强一定,温度升高C的体积分数减小,说明正反应为放热反应,10Mpa,温度升高平衡逆向进行C体积分数减小,a>25.1,图表中温度一定压强增大平衡正向进行,a<64.2,则a取值25.1<a<64.2;
③25min~40min内图中曲线发生变化,XY减少速率增大,C增加速率增大,可能是增大压强速率增大,平衡正向进行,XY物质的量减小,C物质的量增加,改变的条件是缩小容器体积或增大压强;
(4)由电离平衡常数可知,酸性:H2SO3>HNO2>H2CO3>HSO3->HClO>HCO3-,根据强酸制备弱酸,可知H2SO3、HNO2能与碳酸钠反应生成二氧化碳,开始加入的酸较小,反应生成碳酸氢盐,溶液中碳酸氢根增大,全部转化为碳酸氢钠时,再滴加酸又转化为二氧化碳,符合曲线Ⅰ,而HSO3-、HClO与碳酸钠反应只能得到碳酸氢钠,符合曲线Ⅱ,故答案为①③。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色 晶体 | 45 ℃ | 75~85 ℃ | 易溶于水、有机溶剂 |
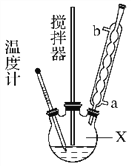
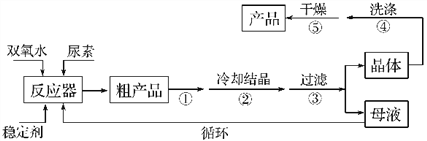
合成过氧化尿素的流程及反应装置图如图:
请回答下列问题:
(1)仪器X的名称是________;冷凝管中冷却水从________(填“a”或“b”)口出来。
(2)该反应的温度控制30 ℃而不能过高的原因是_____________________。
(3)步骤①宜采用的操作是________(填字母)。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是______________________________。
(5)准确称取1.000 g产品于250 mL锥形瓶中,加适量蒸馏水溶解,再加2 mL 6 mol·L-1H2SO4,用0.200 0 mol·L-1 KMnO4标准溶液滴定至终点时消耗18.00 mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”“偏低”或“不变”)。

