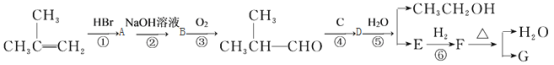
题目内容
【题目】有体积相同的两份营养液,其配方如下:
KCl | K2SO4 | ZnSO4 | ZnCl2 | |
第一份 | 0.3 mol | 0.2 mol | 0.1 mol | —— |
第二份 | 0.1 mol | 0.3 mol | —— | 0.1 mol |
两份营养液中各离子浓度
A.完全不同 B.完全相同 C.仅c(K+)相同 D.仅c(Cl)相同
【答案】B
【解析】第一份溶液c(K+)=0.3 mol+0.2 mol×2=0.7 mol;c(![]() )=0.2 mol+0.1 mol=0.3 mol;c(Cl)=0.3 mol;c(Zn+)=0.1 mol;第二份溶液c(K+)=0.1 mol+0.3 mol×2=0.7 mol;c(
)=0.2 mol+0.1 mol=0.3 mol;c(Cl)=0.3 mol;c(Zn+)=0.1 mol;第二份溶液c(K+)=0.1 mol+0.3 mol×2=0.7 mol;c(![]() )=0.3 mol;c(Cl)=0.1 mol+0.1 mol×2=0.3 mol;c(Zn+)=0.1 mol,故B正确。
)=0.3 mol;c(Cl)=0.1 mol+0.1 mol×2=0.3 mol;c(Zn+)=0.1 mol,故B正确。

 阅读快车系列答案
阅读快车系列答案【题目】(1)已知:① CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g)![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
则CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) ΔH=_________________。
CH4(g)+2H2O(g) ΔH=_________________。
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:
CO(g)+3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图所示。

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由______________________________。
②M点的平衡常数Kp=_____________________。(只列算式。Kp的表达式是将平衡分压代替平衡浓度。某物质的平衡分压=总压×该物质的物质的量分数)
(3)下图表示在一定条件下的1 L的密闭容器中, X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况。下表是3 mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%)。


①X、Y、C三种气体发生反应的化学方程式为_________________________。
②表中a的取值范围是________________________________。
③根据上图和上表分析,25 min~40 min内图中曲线发生变化的原因可能是________。
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.己知:25℃时,几种酸的电离平衡常数如下表所示。
H2CO3 | H2SO3 | HNO2 | HClO |
K1=4.4×10-7 K2=4.7×10-11 | K1=1.2×10-2 K2=6.6×10-8 | K=7.2×10-4 | K=2.9×10-8 |

25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:
①NaHSO3、②HNO2、③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如上图所示。其中符合曲线Ⅱ的溶液为__________。