题目内容
【题目】已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为____。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是____________________。
(3)E的最高价氧化物分子的空间构型是__________,是____分子(填“极性”“非极性”)。
(4)F原子的核外电子排布式是________________。
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为_________。(a)中E原子的配位数为____。若在(b)的结构中取出一个平行六面体作为晶胞,则平均一个晶胞中含有____个F原子。结构(a)与(b)中晶胞的原子空间利用率相比,(a)____(b)(填“>”“<”或“=”)。

【答案】 Na<Al<Si<N NaCl为离子晶体而SiCl4为分子晶体 平面正三角形 非极性 1s22s22p63s23p63d104s2(或[Ar] 3d104s2) ZnS 4 2 =
【解析】C元素是地壳中含量最高的金属元素,即C为Al,D单质的熔点在同周期元素形成的单质中最高,推出D为Si,F2+离子核外各层电子均充满,推出F为Zn,化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子,即E为S,B为Na,A原子核外有三个未成对电子,即A为N,(1)考查第一电离能,金属性越强,第一电离能越小,非金属性越强,第一电离能越大,Na的金属性强于Al,N的非金属性强于Si,因此第一电离能由小到大的顺序是Na<Al<Si<N;(2)考查晶体熔沸点高低,B的氯化物是NaCl,属于离子晶体,D的氯化物是SiCl4,属于分子晶体,一般情况下,离子晶体的熔沸点高于分子晶体;(3)考查空间构型和极性分子判断,E的最高价氧化物是SO3,有3个σ键,孤电子对数为(6-3×2)/2=0,价层电子对数为3,空间构型为平面正三角形,属于非极性分子;(4)考查电子排布式的书写,F为Zn,位于第四周期IIB族,即核外电子排布式为:1s22s22p63s23p63d104s2(或[Ar] 3d104s2);(5)考查晶胞计算,根据(a)S位于顶点和面心,个数为8×1/8+6×1/2=4,Zn位于体内,有4个,化学式为ZnS,根据(a)离S最近的Zn有4个,则S的配位数为4,在(b)的结构中取出一个平行六面体,结构是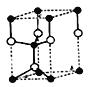 (空心球表示Zn原子), 含有锌原子的个数为4×1/4+1=2,a图种S2-之间形成面心立方堆积,b图种S2-形成六方最密堆积,这两种堆积方式的原子空间利用率相等。
(空心球表示Zn原子), 含有锌原子的个数为4×1/4+1=2,a图种S2-之间形成面心立方堆积,b图种S2-形成六方最密堆积,这两种堆积方式的原子空间利用率相等。

 阅读快车系列答案
阅读快车系列答案
