题目内容
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和__。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
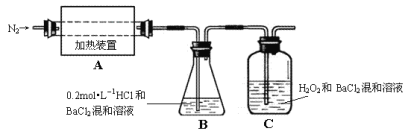
①A中固体充分加热较长时间后,通入氮气,目的是___。
②为验证A中残留物是否含有FeO,需要选用的试剂有___。
A.KSCN溶液 B.浓盐酸 C.KMnO4溶液 D.稀硫酸
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有__气体生成,若含有该气体,观察到的现象为__。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为amol,C中沉淀物质的量为bmol,则b__a(填“大于”、“小于”或“等于”)
⑤现欲将B中溶液准确稀释至100.00mL,应将锥形瓶中的溶液转移入__(填仪器名称)定容。
⑥实验中,观察到C中有白色沉淀生成,则C中发生的反应为__。
【答案】SO2 使分解产生的气体在B、C中被充分吸收 CD SO3 溶液变浑浊 小于 100mL容量瓶 SO2+H2O2=2H++SO42-、SO42-+Ba2+=BaSO4↓(或SO2+H2O2+Ba2+=BaSO4↓+2H+)
【解析】
(1)氮元素和铁元素化合价升高,根据氧化还原反应的规律可知,化合价降低的应该是S元素;
(2)①通入氮气可以使分解生成的气体被完全吸收;
②验证A中残留物是否含有FeO,可将残留物溶于硫酸中,加入KMnO4溶液,观察KMnO4溶液是否褪色;
③氯化钡可与SO3反应生成白色沉淀;
④根据化合价升降守恒进行判断;
⑤准确的配制溶液的仪器为容量瓶;
⑥C中SO2被H2O2氧化为SO42-,SO42-与Ba2+结合生成白色沉淀。
(1)根据氧化还原反应规律,Fe、N元素的化合价均升高,则一定有降低的元素,从所给的产物判断,产物中还应有SO2;
(2)①氯化钡与稀盐酸的混合液目的是吸收氨气、三氧化硫,则过氧化氢和氯化钡的混合液主要吸收二氧化硫,所以通入氮气的目的是使分解产生的气体在B、C中被充分吸收;
②为验证A中残留物是否含有FeO,则选择稀硫酸将固体溶解,然后加入酸性高锰酸钾溶液,若溶液褪色或变浅,证明溶液中含有亚铁离子,则固体中含有FeO;
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有三氧化硫,若含有三氧化硫,则溶液中有硫酸钡沉淀生成,溶液变浑浊;
④若产物中有氮气生成,则失去电子的元素是Fe和N,得到电子的元素是S,根据得失电子守恒,生成bmolFe2O3失去电子的物质的量是2bmol,C中沉淀物质的量为amol,即生成的二氧化硫的物质的量是amol,根据化合价升降必相等,硫降低的化合价(2a)等于铁升高的化合价(2b)和氮升高的化合价之和,则2b小于2a,所以b<a;
⑤标准溶液配制,需要容量瓶,由于配制100.00mL溶液,所以需要100mL容量瓶;
⑥C中的白色沉淀是硫酸钡沉淀,二氧化硫与过氧化氢、氯化钡溶液发生氧化还原反应而生成硫酸钡沉淀,离子方程式为SO2+H2O2=2H++SO42-、SO42-+Ba2+=BaSO4↓(或SO2+H2O2+Ba2+=BaSO4↓+2H+)。