��Ŀ����
����Ŀ��ˮ�е�NO2-�Ǻ����л���ֽ�IJ����Ũ�ȵĴ�С��ˮԴ��Ⱦ�ı�־֮һ��
���ˮ�е�NO2-���ñ�ɫ�����䲽���ǣ�
a�����Ʊ���Һ����ȡ0.30gNaNO2 �� ����ˮ��������ƿ��ϡ����1L����ҺA����ȡ5mL��ҺA��ϡ����1L������ҺB��
b�����Ʊ�ɫ�ף�ȡ6ֻ���Ϊ10mL�ı�ɫ�ܣ����ʵء���С������ͬ�Ҿ�����ƽ���Թܣ����ֱ����������ȵ���ҺB����ϡ����10mL���ټ���������Լ0.3g���Ա������ĩ��ʵ�������±���ʾ��
ɫ����� | 1 | 2 | 3 | 4 | 5 | 6 |
������ҺB�������mL�� | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
c����⣺ȡ10mLˮ�������ɫ���У����������������ᣬ��ɫ�����ɫ�Աȣ�
����д���¿հף�
��1����ɫ���Ļ�����������
��2����ˮ����ɫ����ɫ���е�5����ɫ��ͬ�������ˮ����NO2-����Ϊmg/L��
��3����NaNO2ֱ��������ҺB��ȱ���� ��
��4�����ˮ����ɫ���6�Ż��Ӧ��ȡ�Ĵ�ʩ��
���𰸡�
��1����Һ��ɫ����dz��Ũ�ȵĴ�С������
��2��1.00
��3���ɢڼ����֪��1L��ҺB��ֻ��NO2-1mg�����׳�����ֱ������ҺBʱ����
��4����ˮ����ϡ��һ�����������ظ�ʵ��
����������ͨ���Ƚϻ������ɫ������Һ��ɫ�����ȷ��������ֺ����ķ���Ϊ��ɫ������ɫ���Ļ�����������Һ��ɫ����dz��Ũ�ȵĴ�С�����ȣ����Դ��ǣ���Һ��ɫ����dz��Ũ�ȵĴ�С�����ȣ���O��30g NaNO2���1000mL��ҺA��Ũ��= ![]() =
= ![]() mol/L ����ȡ5��OO mL��ҺA��ϡ����1L��Һ��NaNO2 ���ʵ�����0.0050L��10ml��Һ�к������������ʵ���=
mol/L ����ȡ5��OO mL��ҺA��ϡ����1L��Һ��NaNO2 ���ʵ�����0.0050L��10ml��Һ�к������������ʵ���= ![]() ��10-5mol��1Lˮ���к�NO2-Ϊ
��10-5mol��1Lˮ���к�NO2-Ϊ ![]() ��10-5mol��100��46g/mol=1.00��10-3g=1.00mg�����Դ��ǣ�1.00������NaNO2����ֱ��������ҺB����Ҫ���������������������Ƶ���Һ���������Դ��ǣ��ɢڼ����֪��1L��ҺB��ֻ��NO2-1mg�����׳�����ֱ������ҺBʱ�������ˮ����ɫ���6�Ż��Ӧ��ȡ�Ĵ�ʩ�ǽ�ˮ����ϡ��һ�����������ظ�ʵ�飻���Դ��ǣ���ˮ����ϡ��һ�����������ظ�ʵ��.
��10-5mol��100��46g/mol=1.00��10-3g=1.00mg�����Դ��ǣ�1.00������NaNO2����ֱ��������ҺB����Ҫ���������������������Ƶ���Һ���������Դ��ǣ��ɢڼ����֪��1L��ҺB��ֻ��NO2-1mg�����׳�����ֱ������ҺBʱ�������ˮ����ɫ���6�Ż��Ӧ��ȡ�Ĵ�ʩ�ǽ�ˮ����ϡ��һ�����������ظ�ʵ�飻���Դ��ǣ���ˮ����ϡ��һ�����������ظ�ʵ��.

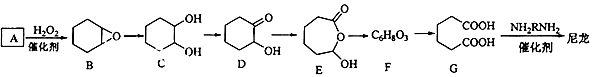
 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�����Ŀ�����Ʊ�ˮ������������������� ![]() ���Ĺ������£�
���Ĺ������£�
����һ����ˮ���ᾧ��Ͷ�뵽������ƿ�У��ټ����������ȱ����ܼ�����ֽ���ʹ������ȫ�ܽ⣬��������������ˮ���Ȼ�����
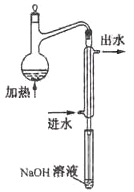
�����������ͼ��ʾװ��װ���������ˮԡ���ȿ����¶���20��40��֮�䣬�ڽ����µμ�SOCl2 �� ��Ӧ�Ƶ�ˮ�����ȡ�
�÷�Ӧ����ʽΪ��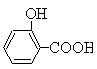 ��ˮ���ᣩ��SOCl2��
��ˮ���ᣩ��SOCl2�� 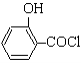 ��ˮ�����ȣ���HCl����SO2��
��ˮ�����ȣ���HCl����SO2��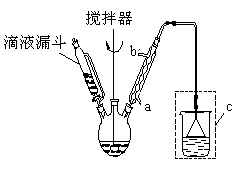
����������������ƿ�л��Һ������80�棬�ټ������������[ ![]() ]���¶ȿ�����100�����ң����Ͻ��衣
]���¶ȿ�����100�����ң����Ͻ��衣
�����ģ����ˡ�����ѹ���ˣ��ƾ�ϴ�ӡ����T�ò�Ʒ��
��1��ʵ��ʱ���������е���ȴˮ����Ϊ ��ѡ�a����b������
��2������һ�м�����ˮ���Ȼ����������� ��
��3���������з�����Ӧ�Ļ�ѧ����ʽΪ ��
��4����PCl3�����ڰ뵼�����������ӡ���ɢ�����й����ʵIJ����������£�
�۵�/�� | �е�/�� | �ܶ�/g��mL��1 | ���� | |
���� | 44.1 | 280.5 | 1.82 | 2P��������+3Cl2 |
PCl3 | -112 | 75.5 | 1.574 | ��ˮ����H3PO3��HCl����O2����POCl3 |
POCl3 | 2 | 105.3 | 1.675 | ��ˮ����H3PO4��HCl��������PCl3 |
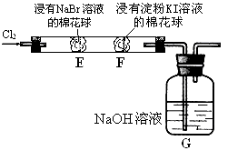
��֪��ͼ��ʵ�����Ʊ�PCl3��װ�ã�����������ʡ�ԣ�����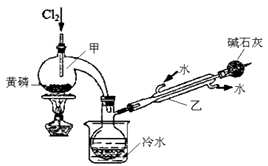
ʵ�����Ʊ�Cl2�����ӷ�Ӧ����ʽΪ����
��5����ʯ�ҵ����ó��˷�ֹ�����е�O2��ˮ�������벢���Ʒ������Ӧ��У���
��6������������ͨ�����Cl2֮ǰ��Ӧ��ͨ��һ��ʱ��ĸ���CO2 �� ��Ŀ������
��7���ⶨ��Ʒ��PCl3���ȵķ������£�Ѹ�ٳ�ȡm g��Ʒ��ˮ����ȫ�����500mL��Һ��ȡ��25��00mL���������c1 mol/L V1 mL ����Һ����ַ�Ӧ������c2 mol/L Na2S2O3��Һ�ζ������ĵ⣬�յ�ʱ����V2 mL Na2S2O3��Һ����֪��H3PO3+H2O+I2=H3PO4+2HI��I2+2Na2S2O3=2NaI+Na2S4O6������ⶨ������û��������Ӧ��������������ݣ�����ò�Ʒ��PCl3����������Ϊ ���ú���ĸ�Ĵ���ʽ��ʾ���ɲ�����