题目内容
【题目】金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子[M(CN)n]m-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
终点时,溶液由黄色变成橙红色。Ag++2CN-=[Ag(CN)2]-
根据以上知识回答下列问题:
(1)水样预处理的目的是。
(2)水样预处理的装置如图,细导管插入吸收液中是为了。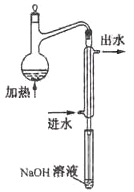
(3)蒸馏瓶比吸收液面要高出很多,其目的是。
(4)如果用盐酸代替磷酸进行预处理,实验结果将(填“偏高”、“无影响”或“偏低”)。
(5)准确移取某工厂污水100 mL,经处理后用浓度为0.010 00 mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00 mL。此水样中含氰化合物的含量为mg·L-1(以CN-计,计算结果保留一位小数)。
【答案】
(1)将含氰化合物全部转化为CN-
(2)完全吸收HCN,防止气体放出
(3)防止倒吸
(4)偏高
(5)109.2
【解析】(1)根据题给信息,污水预处理的目的是将各种形态含氰化合物转化为可以测定的HCN,所以水样预处理的目的是将含氰化合物全部转化为CN- , 所以答案是:将含氰化合物全部转化为CN-;(2)为了保证生成的HCN全部被吸收,导气管要深入NaOH溶液中,所以答案是:完全吸收HCN,防止气体放空;(3)将导气管伸入NaOH溶液中有可能引起倒吸,所以将烧瓶位置挂高,使得蒸馏瓶比吸收液面要高出很多,所以答案是:防止倒吸;(4)如果用盐酸代替磷酸,盐酸具有挥发性,也被NaOH溶液吸收,用硝酸银溶液进行滴定时消耗硝酸银溶液增多,故结果偏高,所以答案是:偏高;(5)根据实验原理,2HCN~2CN-~AgNO3 , m(CN-)=0.01000×21×10-3×2×26×103×10=109.2mg/L,所以答案是:109.2.

 出彩同步大试卷系列答案
出彩同步大试卷系列答案