��Ŀ����
����Ŀ����1��A��B��Ӧ����C���ٶ���Ӧ�տ�ʼֻ��A��B�����ǵ���ʼŨ�Ⱦ�Ϊ1mol/L����Ӧ����2min��A��Ũ��Ϊ0.8mol/L��B��Ũ��Ϊ0.6mol/L��C��Ũ��Ϊ0.6mol/L��������2 min�ڷ�Ӧ��ƽ������VA =_______ mol/(L�� min)��VB =________ mol/(L�� min)���÷�Ӧ2 min��A��B��C�������ʵĻ�ѧ��Ӧ����֮��Ϊ:________________________��
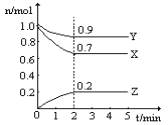
��2��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯��������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
�ٸ÷�Ӧ�Ļ�ѧ����ʽΪ__________________________________________________��
�ڴӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ______________________��
���𰸡� 0.1 0.2 1 ��2 ��3 3X+Y![]() 2Z 0.05mol/(L��min)
2Z 0.05mol/(L��min)
����������1�����ݷ�Ӧ�����ǵ�λʱ����Ũ�ȵı仯���������㣻
��2���������ʵı仯�жϷ�Ӧ�����������ݷ�Ӧ�����ǵ�λʱ����Ũ�ȵı仯�����㡣
��1��A��B��Ӧ����C���ٶ���Ӧ�տ�ʼֻ��A��B�����ǵ���ʼŨ�Ⱦ�Ϊ1mol/L����Ӧ����2min��A��Ũ��Ϊ0.8mol/L��B��Ũ��Ϊ0.6mol/L��C��Ũ��Ϊ0.6mol/L��������2 min�ڷ�Ӧ��ƽ������VA=��1mol/L��0.8mol/L����2min=0.1 mol/(L��min)��VB=��1mol/L��0.6mol/L����2min=0.2 mol/(L��min)����Ӧ����֮������ͬʱ����Ũ�ȵı仯��֮�ȣ��÷�Ӧ2 min��A��B��C�������ʵĻ�ѧ��Ӧ����֮��Ϊ0.2��0.4��0.6��1��2��3��
��2���ٸ���ͼ���֪x��y�����ʵ������٣��Ƿ�Ӧ�z�������2minʱ��Ӧ�ﵽƽ��״̬����ʱx����0.3mol��y����0.1mol��z����0.2mol����˸��ݱ仯��֮���ǻ�ѧ������֮�ȿ�֪�÷�Ӧ�ķ���ʽΪ3X+Y![]() 2Z��
2Z��
�ڴӿ�ʼ��2min��Z��Ũ�ȱ仯����0.2mol��2L��0.1mol/L������ƽ����Ӧ����Ϊ0.1mol/L��2min��0.05mol/(L��min)��