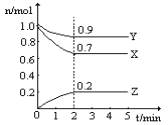
题目内容
【题目】C、N和Si能形成多种高硬度材料,如Si3N4,C3N4,SiC.
(1)Si3N4和C3N4中硬度较高的是______,理由是_________.
(2)C和N能形成一种类石墨结构材料,其合成过程如下图所示。该类石墨结构材料化合物的化学式为_________。其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有_____________。

(3)C和N还能形成一种五元环状有机物咪唑(im),其结构为![]() 。化合物[Co(im)6]SiF6的结构示意图如下:
。化合物[Co(im)6]SiF6的结构示意图如下:
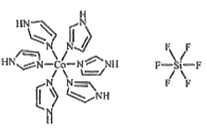
①Co原子的价层电子轨道表达式(价层电子排布图)为_____。N与Co之间的化学键类型是___,判断的理由是__________。
②阴离子SiF62-中心原子Si的价层电子对数为______。阳离子(Co(im)6]2+和SiF62-之间除了阴阳离子间的静电作用力,还存在氢键作用,画出该氢键的表示式_______。
例如水中氢键的表示式为: ![]()
(4)SiC为立方晶系晶体,晶胞參数为a,已知Si原子半径为rSi,C原子半径为rC,该晶胞中原子的分数坐标为:

则SiC立方晶胞中含有____个Si原子、____个C原子,该晶胞中原子的体积占晶胞体积的百分率为__________(列出计算式即可)。
【答案】 C3N4 两者同属原子晶体(答两者结构相似),C的原子半径小于Si,与Si-N相比,C-N的键长短、键能大 C6N8或(C6N8)n或C3N4或(C3N4)n sp2、sp3 ![]() 配位键 N有孤对电子,Co2+有空轨道 6
配位键 N有孤对电子,Co2+有空轨道 6 ![]() 4 4
4 4 ![]()
【解析】(1)相同类型的晶体中,原子半径越小,键能越大,其硬度就越大。所以Si3N4和C3N4中硬度较高的是C3N4原因是两者同属原子晶体,C的原子半径小于Si,与Si-N相比,C-N的键长短、键能大 。(2)由结构可判断出化学式为C6N8或(C6N8)n或C3N4或(C3N4)n 。环中N原子形成2个σ键,含有1对孤电子对,杂化轨道数目为3,采取sp2杂化,氨基中N原子形成3个σ键,含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,(3)①Co原子的价层电子为最外层和次外层电子,其电子轨道表达式为![]() 。因N有孤对电子,Co2+有空轨道,所以N与Co之间可形成配位键。②价层电子对数=成键数+孤电子对数,孤电子对数=(中心原子的最外层电子数-配位原子×与中心原子结合的原子最多能接受的电子数)/2,由此可算出中心原子Si的价层电子对数为4。氢键发生在非金属强的原子和氢原子之间,在该物质中氢键可表示为
。因N有孤对电子,Co2+有空轨道,所以N与Co之间可形成配位键。②价层电子对数=成键数+孤电子对数,孤电子对数=(中心原子的最外层电子数-配位原子×与中心原子结合的原子最多能接受的电子数)/2,由此可算出中心原子Si的价层电子对数为4。氢键发生在非金属强的原子和氢原子之间,在该物质中氢键可表示为![]() 。(4)从该晶胞中原子的分数坐标可看出,每个C原子周围有4个Si原子,每个Si原子有4个C原子,形成正四面体结构,所以SiC立方晶胞中含有4个Si原子、4个C原子。其总体积为4/3πrc3×4+4/3πrsi3×4=16/3π(rc3+ rsi3)。则该晶胞中原子的体积占晶胞体积的百分率为16/3π(rc3+ rsi3)/a3×100%
。(4)从该晶胞中原子的分数坐标可看出,每个C原子周围有4个Si原子,每个Si原子有4个C原子,形成正四面体结构,所以SiC立方晶胞中含有4个Si原子、4个C原子。其总体积为4/3πrc3×4+4/3πrsi3×4=16/3π(rc3+ rsi3)。则该晶胞中原子的体积占晶胞体积的百分率为16/3π(rc3+ rsi3)/a3×100%

【题目】已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]﹣ , 铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法. 【方法一】还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:![]()
有关离子完全沉淀的pH如下表:
有关离子 | Fe2+ | Fe3+ | Cr3+ |
完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O72﹣与FeSO4溶液在酸性条件下反应的离子方程式 .
(2)还原+6价铬还可选用以下的试剂(填序号).
A.明矾
B.铁屑
C.生石灰
D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4 , 再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:(填序号); A.Na2O2 B.Ba(OH)2 C.Ca(OH)2
此时调节溶液的pH范围在(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
(4)【方法二】电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去. 写出阴极的电极反应式 .
(5)电解法中加入氯化钠的作用是: .