题目内容
【题目】实验题
Ⅰ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请 回答下列问题:
(1)指出提取碘的过程中有关实验操作①和③的名称:________;________。
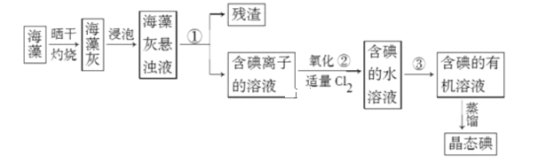
(2)在 3 mL 碘水中,加入 1 mL 四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________ (注:试管中深色区为紫红色溶液)。
Ⅱ.欲配制 480mL0.5mol·L-1 的 NaOH 溶液,试回答下列问题。
(3)配制上述溶液需要的仪器有:药匙、托盘天平、量筒、玻璃棒、________。
(4)应称取的 NaOH 固体的质量为________ g。
(5)某学生实际配制的 NaOH 溶液的浓度为 0.51mol·L-1,原因可能是_________。
A.使用滤纸称量 NaOH 固体 B.容量瓶中原来存有少量水
C.溶解后的烧杯未经多次洗涤 D.用胶头滴管加水定容时俯视刻度
E.加水时超过刻度线,用胶头滴管吸出 F.转移溶液之前未经冷却
【答案】过滤 萃取、分液 D 500 mL 容量瓶、烧杯、胶头滴管 10.0 D F
【解析】
Ⅰ.海带灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用苯或四氯化碳萃取、分液,有机层经蒸馏可得到碘;
Ⅱ.没有规格为480mL的容量瓶,配制时需要选用500mL的容量瓶,实际上配制的是500mL 0.5mol/L的氢氧化钠溶液;依据m=cV/M计算需要溶质氢氧化钠的质量;分析操作对溶质的物质的量和溶液体积的影响,依据C=n/V进行误差分析。
Ⅰ.(1)过滤适用于不溶于水的固体和液体,根据流程可知,分离固体海带灰和液体碘离子的溶液用过滤;因为碘在有机溶剂中的溶解度比水大,且碘和有机溶剂易于分离,所以用萃取然后分液得到含碘的有机溶液,故答案为:过滤;萃取、分液;
(2)碘在四氯化碳中的溶解度大于在水中的溶解度,能将碘水中的碘转移到四氯化碳中,四氯化碳的密度比水大,溶解碘后溶液为紫红色,所以在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是溶液分层,上层颜色接近无色,下层呈紫红色,故选D,故答案为:D;
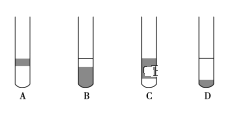
Ⅱ.(3)没有规格为480mL的容量瓶,配制时需要选用500mL的容量瓶,实际上配制的是500mL 0.5mol/L的氢氧化钠溶液,配制步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,需要使用的仪器有:托盘天平、玻璃棒、烧杯、药匙、500mL容量瓶、胶头滴管等,还缺少的玻璃仪器为:烧杯、500mL容量瓶、胶头滴管,故答案为:烧杯、500mL容量瓶、胶头滴管;
(4)配制500mL 0.5mol/L的氢氧化钠溶液,需要氢氧化钠的质量为:m(NaOH)=40g/mol×0.5mol/L×0.5L=10.0g,故答案为:10.0;
(5)某学生实际配制NaOH的溶液的浓度为0.51molL-1,可知配制的浓度偏高。
A、使用滤纸称量氢氧化钠固体,而氢氧化钠容易潮解,故真正的氢氧化钠的质量偏小,故所配溶液的浓度偏低,故A不选;
B、容量瓶中原来存有少量水即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故B不选;
C、溶解后的烧杯未经多次洗涤,会导致溶质的损失,所配溶液浓度偏低,故C不选;
D、胶头滴管加水定容时俯视刻度,溶液体积偏小,浓度偏大,故D选;
E、定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线,溶液的体积偏大,浓度偏低,故E不选;
F、溶液未冷却至室温就注入容量瓶并定容,待冷却后溶液体积偏小,则浓度偏高,故F选;
故选DF,故答案为:DF。

【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下图中______(填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________。
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现_____________________________(填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
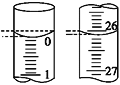
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据列式计算该NaOH溶液的物质的量浓度(写出简要过程)。______________