题目内容
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中观察到一些现象,并产生了相关的思考。
(1)向盛KI溶液的试管中滴加氯水,溶液呈棕黄色。如果继续向试管中滴加氯水,充分振荡,溶液逐渐变浅,最后变成无色。写出并配平溶液由棕黄色变成无色的化学反应方程式(如果系数是1,不用填写):

(2)将KI溶液换成KBr溶液,滴加氯水,溶液呈橙黄色;滴加氯水至过量,颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(3)为证明溴单质的氧化性强于Fe3+,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈棕黄色。为了证明棕黄色溶液是由于Fe3+的存在,而不是溴单质颜色所致,应当采取的补充实验是
(4)在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br—被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为
(1)向盛KI溶液的试管中滴加氯水,溶液呈棕黄色。如果继续向试管中滴加氯水,充分振荡,溶液逐渐变浅,最后变成无色。写出并配平溶液由棕黄色变成无色的化学反应方程式(如果系数是1,不用填写):

(2)将KI溶液换成KBr溶液,滴加氯水,溶液呈橙黄色;滴加氯水至过量,颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(3)为证明溴单质的氧化性强于Fe3+,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈棕黄色。为了证明棕黄色溶液是由于Fe3+的存在,而不是溴单质颜色所致,应当采取的补充实验是
(4)在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br—被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为
(1)I2 + 5Cl2 + 6H2O→2HIO3 + 10HCl
(2)HBrO3>Cl2>HIO3
(3)取少量溶液,在其中滴加KSCN溶液,若溶液变血红色,则说明是Fe3+。(也可以利用苯互四氯化碳做萃取实验)
(4)1.2mol/L
(2)HBrO3>Cl2>HIO3
(3)取少量溶液,在其中滴加KSCN溶液,若溶液变血红色,则说明是Fe3+。(也可以利用苯互四氯化碳做萃取实验)
(4)1.2mol/L
氧化性:氧化剂大于氧化产物
(1)KI被氯气氧化为碘单质,得到棕黄色的碘水:Cl2+2I-=2Cl-+I2;
继续滴加氯水,碘被氧化为KIO3,而氯气只能被还原为氯呈—1价的HCl:I2 + 5Cl2 + 6H2O=2HIO3 + 10HCl
从上式可得出氧化性:Cl2>HIO3
(2)KBr被氯气氧化为溴单质,得到橙黄色的溴水:Cl2+2Br-=2Cl-+Br2;但氯气并不能将溴单质继续氧化为HBrO3,从反面说明氧化性HBrO3>Cl2,综合可知氧化性:HBrO3>Cl2>HIO3
(3)溴可将浅绿色的Fe2+氧化为棕黄色的Fe3+:2Fe2++Br2=2Br-+2Fe3+,但溴单质在水中呈现的颜色也非常接近于棕黄色,由于提供了足量的稀氯化亚铁溶液,如果上式发生,则溶液中生成Fe3+,可通过KSCN溶液来检验;或者用有机溶液来萃取溴,观察有机层的颜色也可判定溶液中是否还存在溴单质
(4)由上面可知,还原性Fe2+>Br-,故氯气首先氧化Fe2+再氧化Br-
设FeBr2的物质的量为amol,由电子的得失守恒可知:a+2a/3=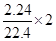 ,求得a=0.12mol
,求得a=0.12mol
故原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L
(1)KI被氯气氧化为碘单质,得到棕黄色的碘水:Cl2+2I-=2Cl-+I2;
继续滴加氯水,碘被氧化为KIO3,而氯气只能被还原为氯呈—1价的HCl:I2 + 5Cl2 + 6H2O=2HIO3 + 10HCl
从上式可得出氧化性:Cl2>HIO3
(2)KBr被氯气氧化为溴单质,得到橙黄色的溴水:Cl2+2Br-=2Cl-+Br2;但氯气并不能将溴单质继续氧化为HBrO3,从反面说明氧化性HBrO3>Cl2,综合可知氧化性:HBrO3>Cl2>HIO3
(3)溴可将浅绿色的Fe2+氧化为棕黄色的Fe3+:2Fe2++Br2=2Br-+2Fe3+,但溴单质在水中呈现的颜色也非常接近于棕黄色,由于提供了足量的稀氯化亚铁溶液,如果上式发生,则溶液中生成Fe3+,可通过KSCN溶液来检验;或者用有机溶液来萃取溴,观察有机层的颜色也可判定溶液中是否还存在溴单质
(4)由上面可知,还原性Fe2+>Br-,故氯气首先氧化Fe2+再氧化Br-
设FeBr2的物质的量为amol,由电子的得失守恒可知:a+2a/3=
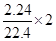 ,求得a=0.12mol
,求得a=0.12mol故原FeBr2溶液中FeBr2的物质的量浓度为1.2mol/L

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目


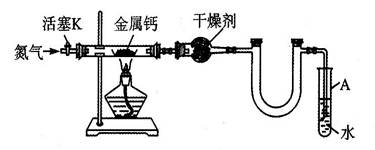
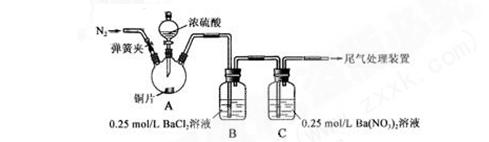
 未发现白色沉淀溶解
未发现白色沉淀溶解 应。
应。 ①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________; 于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
 .
.