题目内容
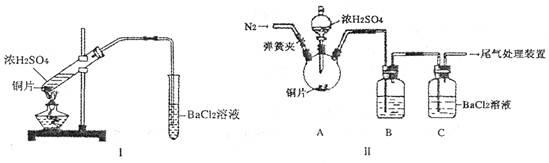
某校研究性学习小组设计了如下实验步骤来提取碘:
①加H2O2②将海带烧成灰,向灰中加水搅拌③加CC14振荡④过滤⑤用分液漏斗分液。合理的操作顺序为
①加H2O2②将海带烧成灰,向灰中加水搅拌③加CC14振荡④过滤⑤用分液漏斗分液。合理的操作顺序为
| A.②→④→①→③→⑤ | B.②→①→③→④→⑤ |
| C.③→①→②→⑤→④ | D.①→③→⑤→②→④ |
A
要提取碘,则应该用氧化剂把碘离子氧化生成单质碘,然后利用碘单质易溶在有机溶剂中,通过萃取即可,答案选A。

练习册系列答案
相关题目


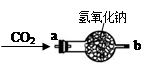
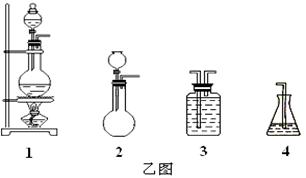
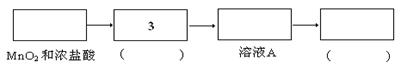
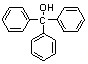 )是重要的有机合成中间体,实验室中合成三苯甲醇时采用图2所示的装置,其合成流程如图1所示。
)是重要的有机合成中间体,实验室中合成三苯甲醇时采用图2所示的装置,其合成流程如图1所示。
 (碱式溴化镁);
(碱式溴化镁);
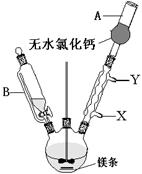

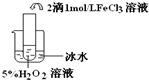
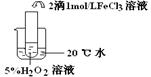
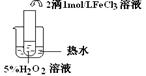
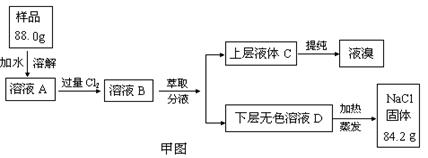
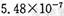 ,饱和亚硫酸中
,饱和亚硫酸中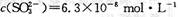 。
。