题目内容
(12分)某研究性学习小组利用手持技术探究强碱和不同的酸中和反应的过程如下:
(1)实验步骤:
①分别配制浓度均为0.1mol·L-1的NaOH、HC1、CH3 C00H、H3PO4溶液备用。配制过程中用到的玻璃仪器有烧杯、容量瓶、玻璃棒、细口瓶、____、____。
②在锥形瓶中加入10mL0.1 mol.L-1的HC1,在25.00mL____(填“酸式”、“碱式”)滴定管中加入0.1 mol.L-1的NaOH,连接数据采集器和pH传感器。
③向锥形瓶中滴入NaOH,接近估算的NaOH用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH。
④存储计算机绘制的pH变化图。用0.1 mol·L-1的CH3 C00H、H3 P04溶液代替HC1重复上述②~④的操作。
(2)结果分析:20℃时NaOH分别滴定HC1、CH3 C00H、H3 P04的pH变化曲线如下。
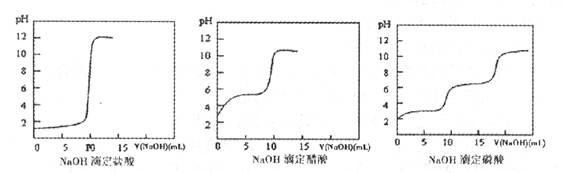
根据上述曲线回答下列问题:
①20℃时,三种酸从强到弱的顺序是 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
③醋酸恰好中和时pH≈8的原因是 ;
④你认为前述的步骤中,NaOH滴定磷酸是否可行? (填“可行”、“不可行”)。
(1)实验步骤:
①分别配制浓度均为0.1mol·L-1的NaOH、HC1、CH3 C00H、H3PO4溶液备用。配制过程中用到的玻璃仪器有烧杯、容量瓶、玻璃棒、细口瓶、____、____。
②在锥形瓶中加入10mL0.1 mol.L-1的HC1,在25.00mL____(填“酸式”、“碱式”)滴定管中加入0.1 mol.L-1的NaOH,连接数据采集器和pH传感器。
③向锥形瓶中滴入NaOH,接近估算的NaOH用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH。
④存储计算机绘制的pH变化图。用0.1 mol·L-1的CH3 C00H、H3 P04溶液代替HC1重复上述②~④的操作。
(2)结果分析:20℃时NaOH分别滴定HC1、CH3 C00H、H3 P04的pH变化曲线如下。

根据上述曲线回答下列问题:
①20℃时,三种酸从强到弱的顺序是 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
③醋酸恰好中和时pH≈8的原因是 ;
④你认为前述的步骤中,NaOH滴定磷酸是否可行? (填“可行”、“不可行”)。
(12分)
(1)①胶头滴管、量筒 ②碱式
(2)①盐酸>磷酸>醋酸;
②醋酸是弱酸,中和反应生成的醋酸根离子对醋酸的电离产生抑制;
③中和后生成的醋酸钠水解使溶液显碱性
④不可行
(1)①胶头滴管、量筒 ②碱式
(2)①盐酸>磷酸>醋酸;
②醋酸是弱酸,中和反应生成的醋酸根离子对醋酸的电离产生抑制;
③中和后生成的醋酸钠水解使溶液显碱性
④不可行
(1)①配制溶液的过程中,除已知玻璃仪器外,还需要用量筒量取适量溶液,用胶头滴管定容 ②碱性溶液应该用碱式滴定管盛装
(2)①向三种酸性溶液中滴加碱液,溶液的pH均升高,由于弱酸溶液中存在电离平衡,可不断电离出H+,故pH升高的速率相对较慢,所以由三图像可看出,三种酸从强到弱的顺序为盐酸>磷酸>醋酸
②醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,而在中和过程中:CH3COOH+OH-=CH3COO-+H2O,生成的CH3COO-将对酸酸的电离产生抑制作用,将导致滴定开始后醋酸曲线变化比盐酸快
CH3COO-+H+,而在中和过程中:CH3COOH+OH-=CH3COO-+H2O,生成的CH3COO-将对酸酸的电离产生抑制作用,将导致滴定开始后醋酸曲线变化比盐酸快
③醋酸与碱液恰好中和时生成醋酸钠溶液:CH3COOH+NaOH-=CH3COONa+H2O,而醋酸钠水解导致溶液呈碱性:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
④磷酸为三元酸,有多个“pH突跃”,而题目滴定过程中,只可能出现一个pH突跃,故不可行
(2)①向三种酸性溶液中滴加碱液,溶液的pH均升高,由于弱酸溶液中存在电离平衡,可不断电离出H+,故pH升高的速率相对较慢,所以由三图像可看出,三种酸从强到弱的顺序为盐酸>磷酸>醋酸
②醋酸溶液中存在电离平衡:CH3COOH
 CH3COO-+H+,而在中和过程中:CH3COOH+OH-=CH3COO-+H2O,生成的CH3COO-将对酸酸的电离产生抑制作用,将导致滴定开始后醋酸曲线变化比盐酸快
CH3COO-+H+,而在中和过程中:CH3COOH+OH-=CH3COO-+H2O,生成的CH3COO-将对酸酸的电离产生抑制作用,将导致滴定开始后醋酸曲线变化比盐酸快③醋酸与碱液恰好中和时生成醋酸钠溶液:CH3COOH+NaOH-=CH3COONa+H2O,而醋酸钠水解导致溶液呈碱性:CH3COO-+H2O
 CH3COOH+OH-
CH3COOH+OH-④磷酸为三元酸,有多个“pH突跃”,而题目滴定过程中,只可能出现一个pH突跃,故不可行

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
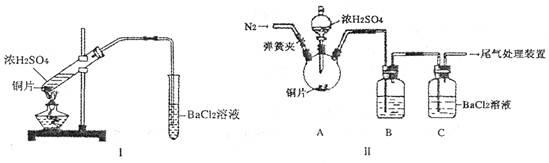
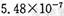 ,饱和亚硫酸中
,饱和亚硫酸中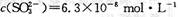 。
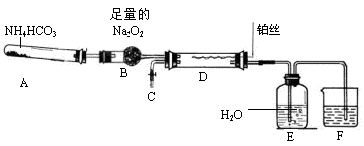
。
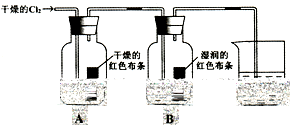
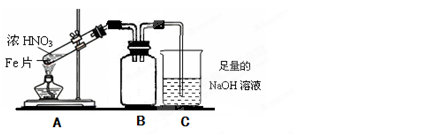

 验
验