题目内容
【题目】二甲醚(CH3OCH3)是一种可再生绿色新能源,被誉为“21世纪的清洁燃料”。
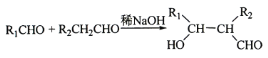
(1)写出二甲醚一种同分异构体的结构简式:____________。
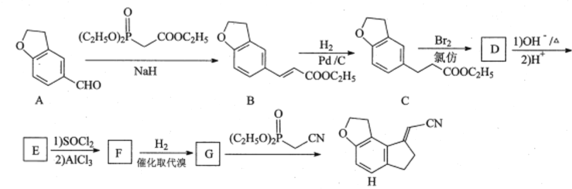
(2)CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)是____________反应(填“吸热”或“放热”),该反应过程的能量变化示意图可用下图中的____________表示(填“A”或“B”)。
(3)工业上可用水煤气合成二甲醚:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)
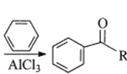
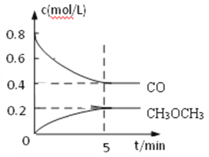
①测得CO和CH3OCH3(g)的浓度随时间变化如图所示,则反应开始至平衡时CO的平均反应速率v(CO)=________mol/(L·min)。
②该反应在恒容密闭容器中进行,下列叙述中能表示该反应达到平衡状态的是____________。
A.单位时间内生成CO和H2的物质的量之比为1﹕2
B.CH3OCH3的浓度不再变化
C.容器内压强不再变化
D.CH3OCH3与H2O的物质的量相等
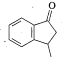
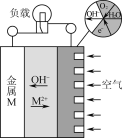
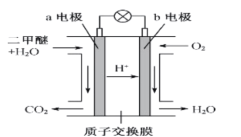
(4)二甲醚燃料电池工作原理如图所示,则a电极的电极名称为____________极(填“正”或“负”)。
 .
.
【答案】CH3CH2OH 放热 A 0.08 BC 负
【解析】
二甲醚和乙醇互为同分异构体,写出乙醇的结构简式;二甲醚的氧化反应是放热的,根据反应物的能量高于生成物的能量进行判断正确的能量图;根据v=![]() 计算平均反应速率;根据化学平衡的判断依据判断;根据燃料电池的氧气为正极,燃料为负极进行判断。
计算平均反应速率;根据化学平衡的判断依据判断;根据燃料电池的氧气为正极,燃料为负极进行判断。
(1)二甲醚的一种同分异构体为乙醇,乙醇的的结构简式:CH3CH2OH;
(2)CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)是放热反应,反应物的总能量高于生成物的总能量,符合该反应过程的能量变化示意图为图A;
(3)工业上可用水煤气合成二甲醚:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)
①由图可知,CO的初始浓度为0.8mol/L,平衡时的浓度为0.4mol/L,则反应开始至平衡时CO的平均反应速率v(CO)=![]() =0.08 mol/(L·min);
=0.08 mol/(L·min);
②根据化学反应:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)
A.单位时间内生成CO和H2的物质的量之比为1﹕2,不能代表反应达到平衡状态,故A不符合题意;
B.CH3OCH3的浓度不再变化,代表反应达到平衡状态,故B符合题意;
C.该反应压强是一个变值,容器内压强不再变化时代表反应达到平衡状态,故C符合题意;
D.CH3OCH3与H2O的物质的量相等,可能处于平衡状态,也可能不处于平衡状态,故D不符合题意;
答案选BC。
(4)二甲醚燃料电池中,则a电极通入二甲醚,电极名称为负极,通入氧气的一极为正极。

 阅读快车系列答案
阅读快车系列答案