题目内容
17.在1-18号元素中(稀有气体元素除外),能形成最稳定气态氢化物的元素是F;与水或酸反应最剧烈的单质是Na;最高价氧化物的水化物中碱性最强是NaOH;最高价氧化物的水化物中酸性最强是HClO4.(用元素符号或化学式回答)分析 同周期自左而右元素非金属性增强、金属性减弱,同主族自上而下元素非金属性减弱、金属性增强,非金属性越强,形成的氢化物越稳定;金属性越强,金属单质与水反应越剧烈,最高价氧化物对应水化物的碱性越强;氟元素没有最高价含氧酸,故最高价氧化物的水化物中酸性最强是高氯酸.
解答 解:同周期自左而右元素非金属性增强、金属性减弱,同主族自上而下元素非金属性减弱、金属性增强,在1-18号元素中(稀有气体元素除外),非金属性最强的元素为F,其形成的氢化物HF最稳定,金属性最强的为Na,与水反应最剧烈,形成的碱NaOH碱性最强;氟元素没有最高价含氧酸,故Cl元素最高价氧化物的水化物高氯酸的酸性最强,故答案为:F;Na;NaOH;HClO4.
点评 本题考查元素周期律,比较基础,侧重对基础知识的巩固,掌握同周期、同主族元素性质递变规律.

练习册系列答案
相关题目
7.将30mL一定浓度的硝酸与4.51g铜片反应,当铜片全部反应后,共生成2.24L气体(准标状况).则硝酸的物质的量浓度至少为( )
| A. | 9 mol/L | B. | 8 mol/L | C. | 5 mol/L | D. | 10 mol/L |
8.下列说法正确的是( )
| A. | 将明矾加入海水中静置过滤是海水淡化的方法之一 | |
| B. | 海水晒盐的过程发生复分解反应 | |
| C. | 海水中提取镁的过程不涉及氧化还原反应 | |
| D. | 从海水中提取铀等微量元素是海水资源综合利用研究方向之一 |
5.已知价电子数相同的离子或分子结构相似,如SO3、NO3-都是平面三角形.那么下列分子或离子中与SO42-有相似结构的是( )
| A. | PCl5 | B. | CCl4 | C. | NF3 | D. | N3- |
12.用一种试剂区别,苯、苯酚溶液、CCl4、己烯四种无色液体,最好选用( )
| A. | 溴水 | B. | FeCl3溶液 | C. | 高锰酸钾溶液 | D. | 水 |
9.下列说法中正确的是( )
| A. | HCl中存在离子键,属于离子化合物 | |
| B. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| C. | 阴阳离子通过静电引力而形成的化学键称为离子键 | |
| D. | 非金属元素组成的化合物中只含共价键 |
6.25℃时,在0.01 mol•L-1的硫酸溶液中,水电离出的H+浓度是( )
| A. | 5×10-13 mol•L-1 | B. | 0.02 mol•L-1 | ||
| C. | 1×10-7 mol•L-1 | D. | 1×10-12 mol•L-1 |
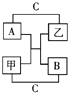 A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间 存在如下关系:若A为单质有色气体,请判断:(填化学式)A是Cl2,B是S,C是H2,甲是H2S,乙是HCl.
A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间 存在如下关系:若A为单质有色气体,请判断:(填化学式)A是Cl2,B是S,C是H2,甲是H2S,乙是HCl.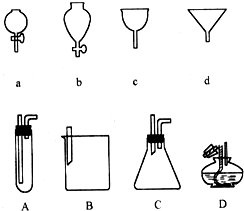 如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.
如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.