题目内容
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,要提高反应的速率和尾气的转化率,采取的措施是( )
2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,要提高反应的速率和尾气的转化率,采取的措施是( )
A.降低温度
B.增大压强
C.在发生反应的密封容器中充入氦气
D.及时将CO2和N2从反应体系中移走
【答案】B
【解析】
A.降低温度,化学反应速率减慢,化学平衡向放热方向移动,即正反应方向,NO的转化率增大,故A错误;
B.增大压强平衡向正反应方向移动,NO的转化率增大,且化学反应速率加快,故B正确;
C.在发生反应的密封容器中充入氦气,虽然压强增大,但容器的体积不变,对反应体系无影响,不影响平衡移动,故C错误;
D.将CO2和N2从反应体系中移走,平衡向正反应方向移动,NO的转化率增大,但反应速率减小,故D错误。
答案选B。

 阅读快车系列答案
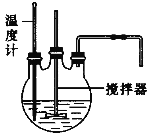
阅读快车系列答案【题目】以反应![]() 为例探究“外界条件对化学反应速率的影响"。实验时,分别量取
为例探究“外界条件对化学反应速率的影响"。实验时,分别量取![]() 溶液和酸性
溶液和酸性![]() 溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 |
| 酸性 | 温度/℃ | ||
浓度 | 体积 | 浓度 | 体积 | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
下列说法不正确的是( )
A.实验①、②、③所加的![]() 溶液均要过量
溶液均要过量
B.实验①测得![]() 溶液的褪色时间为40 s,则这段时间内平均反应速率
溶液的褪色时间为40 s,则这段时间内平均反应速率![]()
C.实验①和②探究浓度对反应速率的影响,实验②、③探究温度对反应速率的影响
D.3组实验中均发现起初反应较慢,过了一会儿速率突然增大,可能是生成的![]() 对反应起催化作用
对反应起催化作用
【题目】研究和深度开发CO、CO2的应用对建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJmol-1,
C(s)+CO2(g)=2CO(g) △H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为____________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
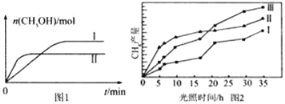
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI______KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为____________。
(4)利用光能和光催化剂,可将CO2和H2(g)转化为CH4和O2,紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号)
(5)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
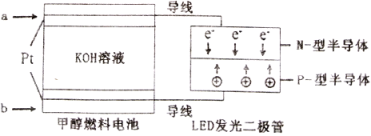
请写出加入(通入)b物质一极的电极反应式________________;每消耗6.4g甲醇转移的电子数为_______________。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的醋酸与bmol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为__________________。