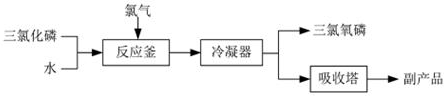
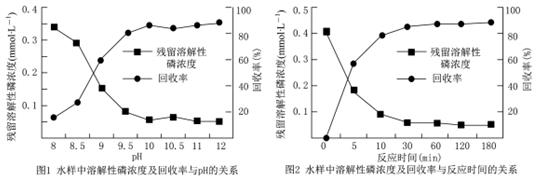
题目内容
6.某温度下:A+B?2C,反应达到平衡状态.(1)如果A为气体,且增大压强时,通过平衡移动使A的平衡浓度增大,则B为固体或纯液体(填“状态”),
(2)如果减少或增加B物质的量,平衡不移动,则B是固体或纯液体(填“状态”).
(3)如果升温,C的平衡浓度降低,此反应的逆反应是吸热(填“吸热”或“放热”)反应.
分析 (1)如果A为气体,且增大压强时,通过平衡移动使A的平衡浓度增大,平衡逆向进行,增大压强平衡向气体体积减小的方向进行;
(2)固体和纯溶剂不影响化学平衡;
(3)升温平衡向吸热反应方向进行.
解答 某温度下:A+B?2C,反应达到平衡状态
(1)如果A为气体,且增大压强时,通过平衡移动使A的平衡浓度增大,平衡逆向进行,增大压强平衡向气体体积减小的方向进行,逆向是气体体积减小的反应,则B为固体,C为气体,
故答案为:固体或纯液体;
(2)固体和纯溶剂不影响化学平衡,如果减少或增加B物质的量,平衡不移动,说明B为固体或纯液体,
故答案为:固体或纯液体;
(3)升温平衡向吸热反应方向进行,如果升温,C的平衡浓度降低,说明平衡逆向进行,逆向反应是吸热反应,正反应为放热反应,
故答案为:吸热.
点评 本题考查了化学平衡影响因素的分析判断,主要是压强对化学平衡的影响分析应用,掌握平衡移动原理是解题关键,题目较简单.

练习册系列答案
相关题目
14.下列选项正确的是( )
| A. | 使PH试纸变成红色的溶液,可能存在大量的:NH4+、Cu2+、ClO-、Cl- | |
| B. | (NH4)2Fe(SO4)2溶液中,可能存在大量的:K+、Cu2+、Cl-、MnO4- | |
| C. | 硫酸酸化的淀粉KI溶液在空气中变成蓝色:4I-+O2+2H2O═2I2+4OH- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
1.下列离子方程式正确的是( )
| A. | 向Fe(NO3)3 溶液中滴入少量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 向AlCl3 溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Cu(OH)2沉淀溶于氨水得到深蓝色溶液:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O | |
| D. | 澄清石灰水中加入少量NaHCO3 溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
18.下列气体属于居室空气污染的主要来源之一的是( )
| A. | 甲烷 | B. | 甲醛 | C. | 醋酸 | D. | 二氧化硫 |