题目内容
【题目】过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
(1)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是___。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
(2)2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。

①用A、B、O表示这类特殊晶体的化学式:___。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁转变及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:___。(用含x的代数式表示)
③Mn的核外电子排布式为:___。
④下列有关说法正确的是___。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
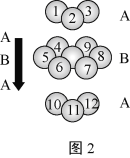
D.铬的堆积方式与钾相同,则其堆积方式如图2
【答案】ABCD ABO3 ![]() 1s22s22p63s23p63d54s2 AC
1s22s22p63s23p63d54s2 AC
【解析】
(1)A.价电子总数和原子个数相等的微粒互为等电子体
B.甲醛、苯分子中碳原子均含有3个δ键,没有孤对电子;
C.苯、二氧化碳分子的空间结构对称,,水和甲醛分子的空间结构不对称;
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键;
(2)①利用均摊法计算晶体的化学式;
②根据化合价代数和为0的原则计算;
③Mn的原子序数为25,位于元素周期表中第四周期VIIB族;
④A.由金属在周期表中的位置判断;
B.N元素原子p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
C.元素的电负性越强,金属性越弱;
D.由图可知,图中堆积方式为六方最密堆积。
(1)A.价电子总数和原子个数相等的微粒互为等电子体,苯与B3N3H6的原子个数均为12,价电子数均为30,互为等电子体,故A正确;
,采用sp2杂化,故B正确;
C.苯、二氧化碳分子的空间结构对称,属于是非极性分子,水和甲醛分子的空间结构不对称,属于极性分子,故C正确;
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键,故D正确;
ABCD正确,故答案为:ABCD;
(2)①由图可知,晶胞中A位于顶点,晶胞中含有A为8×![]() =个,B位于晶胞的体心,含有个,O位于面心,晶胞中含有O的个数为6×
=个,B位于晶胞的体心,含有个,O位于面心,晶胞中含有O的个数为6×![]() =3,则化学式为ABO3,故答案为:ABO3;
=3,则化学式为ABO3,故答案为:ABO3;
②设La1-xAxMnO3中三价锰的物质的量为m,则四价锰的物质的量为(1—m),由化合价代数和为0可得关系式3(1—x)+2x+3m+4(1—m)+3×(—2)=0,解得m=1—x,则三价锰与四价锰的物质的量之比为![]() ,故答案为:
,故答案为:![]() ;
;
③Mn的原子序数为25,位于元素周期表中第四周期VIIB族,核外电子排布式为1s22s22p63s23p63d54s2(或[Ar]3d54s2),故答案为:1s22s22p63s23p63d54s2;
④A.由金属在周期表中的位置可知镧、锰、氧分别位于周期表f、d、p区,故A正确;
B.O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故B错误;
C.元素的电负性越强,金属性越弱,故C正确;
D.由图可知,图中堆积方式为六方最密堆积,铬的堆积方式与钾相同,应为体心立方堆积,故D错误;
AC正确,故答案为:AC。

 阅读快车系列答案
阅读快车系列答案【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
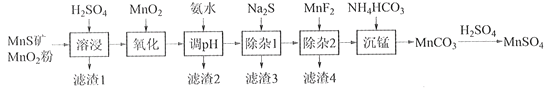
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
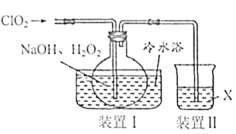
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
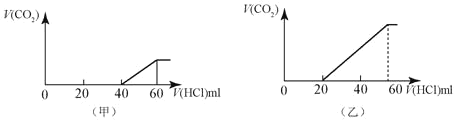
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
【题目】(1)室温下,2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,写出1molC6H6完全燃烧的热化学方程式:______。
(2)已知:Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s)△H=+akJmol-1;C(s)+O2(g)=CO2(g)△H=-bkJmol-1,则2Fe(s)+
CO2(g)+2Fe(s)△H=+akJmol-1;C(s)+O2(g)=CO2(g)△H=-bkJmol-1,则2Fe(s)+![]() O2(g)=Fe2O3(s)的△H=________。
O2(g)=Fe2O3(s)的△H=________。
(3)已知几种化学键的键能如表所示:
化学键 | Cl—Cl | F—F | Cl—F |
键能/ kJ·mol—1 | 242 | 159 | 172 |
则反应Cl2(g)+3F2(g)![]() 2ClF3(g)的△H=_____________ kJ·mol-1。
2ClF3(g)的△H=_____________ kJ·mol-1。
(4)如图是乙烷、二甲醚燃烧过程中的能量变化图。
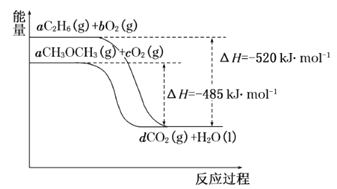
请回答下列问题:
①乙烷的燃烧热ΔH=_______kJ·mol-1。
②根据题图写出二甲醚完全燃烧时的热化学方程式__________。