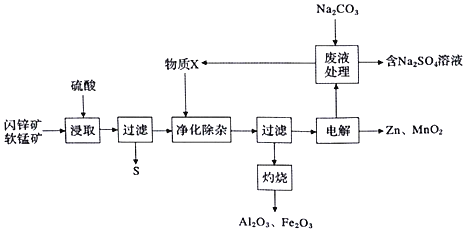
题目内容
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

T ℃时相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | T ℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=1.00×10-5 |
(1)“酸浸”前将废料粉碎,其目的是____________________。
(2)调节pH步骤中,溶液pH的调节范围是________________。
(3)滤渣1主要成分的化学式是CaSO4和_____,滤渣3主要成分的化学式______。
(4)写出氧化步骤中加入H2O2发生反应的离子方程式:_______________。
(5)酸浸过程中,1 mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应化学方程式:______________________。
(6)沉镍过程中,若c(Ni2+)=2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1.0×10-5 mol/L],则需要加入Na2CO3(M=106 g/mol)固体的质量最少为_____g。
(7)加入醋酸进行酸溶得到醋酸镍溶液,一定条件指的是 ________、________过滤、洗涤、干燥得到醋酸镍产品。
【答案】加快反应速度,提高镍的浸出率 5.0≤pH<6.7 SiO2 CaF2 2Fe2++H2O2+2H+=2Fe3++2H2O NiS+H2SO4+2HNO3=NiSO4+SO2↑+2NO↑+2H2O 31.8 蒸发浓缩 冷却结晶
【解析】
制取醋酸镍的工艺流程为:含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,NiS、Al2O3、FeO、CaO会发生反应,NiS、Al2O3、FeO产生相应的盐进入溶液,SiO2不能反应,CaO反应后转化为微溶于水的CaSO4,所以反应后过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把溶液中的Fe2+氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为Al(OH)3、Fe(OH)3沉淀,所以滤渣2为Al(OH)3、Fe(OH)3,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,向溶液中加入NH4F,溶液中的Ca2+与F-会发生反应产生CaF2沉淀,过滤,滤渣3为CaF2,向滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体。
(1)“酸浸”前将废料粉碎,其目的是可增大固体接触面积,从而提高了镍的浸出率。
(2)H2O2把溶液中的Fe2+氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为Al(OH)3、Fe(OH)3沉淀,所以滤渣2为Al(OH)3、Fe(OH)3,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7。
(3)根据上述分析可知滤渣1主要成分的化学式是CaSO4和SiO2,向含有Ni2+的滤液中加入NH4F,溶液中的Ca2+与F-会发生反应产生CaF2沉淀,所以滤渣3主要成分的化学式CaF2。
(4)在氧化步骤中,加入H2O2,可以发生氧化还原反应,把Fe2+氧化为Fe3+,反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O。
(5)在用H2SO4、HNO3进行酸浸过程中,1 mol NiS失去6NA个电子,被氧化产生NiSO4,同时得到SO2、NO两种无色有毒气体。该反应化学方程式:NiS+H2SO4+2HNO3=NiSO4+SO2↑+2NO↑+2H2O。
(6)已知NiCO3的Ksp=1.0×10-5,使100ml该滤液中的Ni2+沉淀物完全,则c(Ni2+)≤10-5mol/L,溶液中c(CO32-)=![]() mol/L=1.0mol/L,与Ni2+反应的n(CO32-)=2mol/L×0.1L=0.2mol,则加入的碳酸钠的总物质的量:n(CO32-)=0.2mol+1.0mol/L×0.1L=0.3mol,所以需要加入Na2CO3固体的质量最少m(Na2CO3)=0.3mol×106g/mol=31.8g;
mol/L=1.0mol/L,与Ni2+反应的n(CO32-)=2mol/L×0.1L=0.2mol,则加入的碳酸钠的总物质的量:n(CO32-)=0.2mol+1.0mol/L×0.1L=0.3mol,所以需要加入Na2CO3固体的质量最少m(Na2CO3)=0.3mol×106g/mol=31.8g;
(7)加入醋酸进行酸溶得到醋酸镍溶液,将该溶液蒸发浓缩、冷却结晶,然后过滤、洗涤、干燥得到醋酸镍产品。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案【题目】甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g)![]() C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
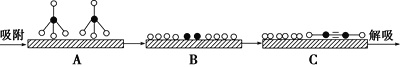
①若用![]() 和
和![]() 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图所示,t0 ℃后CH4的转化率突减的原因可能是_______。

(3)甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图所示:
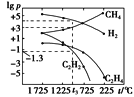
①t1 ℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________。(保留3位有效数字)若改变温度至t2 ℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________t2(填“>”“=”或“<”)。
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________。(保留3位有效数字)若改变温度至t2 ℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________t2(填“>”“=”或“<”)。
②在图中,t3 ℃时,化学反应2CH4(g)![]() C2H2(g)+3H2(g)的压强平衡常数Kp=____。
C2H2(g)+3H2(g)的压强平衡常数Kp=____。
(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为____________。
(5)设计如图实验探究牺牲阳极的阴极保护法原理:
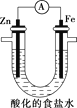
操作 | 现象 |
(i)取铁极附近的溶液于试管中,滴加铁氰化钾溶液 | 无明显现象 |
(ii)在U形管铁极附近滴加铁氰化钾溶液 | 产生蓝色沉淀 |
得出结论:①锌______保护铁;(填“能”或“不能”)
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成______。